

科普文章
转移性黑色素瘤对免疫检查点抑制剂的耐药性及新免疫疗法
转移性黑色素瘤对免疫检查点抑制剂的原发性和获得性耐药限制了患者的治疗获益。肿瘤耐药性机制涉及到肿瘤细胞、免疫微环境和宿主的多个信号通路的复杂过程。开发新的治疗方案克服癌症治疗的耐药性值得深入研究和探索。新免疫疗法在肿瘤免疫循环的各个阶段发挥作用,联合治疗有望为转移性黑色素瘤患者治疗提供更有效的治疗方案。
1. 转移性黑色素瘤对ICIs的原发性和获得性耐药[1]
免疫检查点抑制剂(ICIs)疗法显著改善了晚期转移性黑色素瘤及其他实体癌症患者的治疗效果。然而,无论化疗、靶向治疗、免疫治疗都存在的耐药性限制了疗效。尽管相较靶向治疗和化疗,免疫细胞的记忆功能通常使免疫治疗的耐药性出现的更晚。
一部分患者最初对免疫治疗有反应,后来复发并产生治疗耐药,称为获得性耐药。另一些患者则对初始治疗就完全无反应,称为原发性耐药。原发性和获得性耐药是进一步改善转移性黑色素瘤患者预后的关键临床障碍。
免疫治疗耐药的机制是宿主、肿瘤细胞、免疫微环境共同作用的结果,涉及到肿瘤免疫循环中的多种组成成分,以及多个信号分子和通路之间的变化。由于这种复杂性,目前对耐药机制的认识还不完全。克服治疗耐药需要彻底了解肿瘤免疫逃逸的潜在机制(图1)。
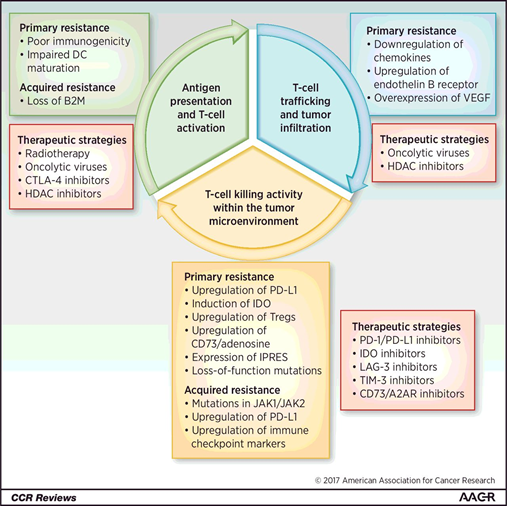
图1.肿瘤免疫循环 [1]。有效诱导抗肿瘤免疫反应需要:1)抗原提呈和T细胞激活;2)T细胞转运和肿瘤浸润;3)肿瘤微环境中T细胞的杀伤活性。各个阶段出现的免疫逃逸都可导致对免疫治疗的原发性或获得性耐药。潜在的治疗策略作用在每个阶段以克服免疫治疗耐药性。A2AR:A2A受体;B2M:β2微球蛋白;HDAC:组蛋白去乙酰化酶;JAK1/JAK2:人类酪氨酸激酶1和2;IDO:吲哚胺2,3-双加氧酶;IPRES:天然抗PD1抵抗基因特征;LAG-3:淋巴细胞激活基因3;TIM-3:T细胞免疫球蛋白和粘蛋白结构域3;Tregs:调节性T细胞;VEGF:血管内皮生长因子。
2. 新免疫疗法治疗转移性黑色素瘤[2]
在利用免疫检查点抑制剂治愈的转移性黑色素瘤患者中,约2/3的患者会对ICIs有原发性或继发性耐药。因此,许多新的治疗方案单独或与CTLA-4或PD-1阻断剂联合克服这种耐药性。研究了不同的新的免疫治疗方法用于PD-1或CTLA-4抗体治疗复发的晚期黑色素瘤患者。新免疫疗法根据“肿瘤免疫循环”不同阶段进行分类,包括1)T细胞启动和激活;2)T细胞转运和肿瘤浸润;3)T细胞识别肿瘤抗原和肿瘤杀伤。主要是基于单克隆抗体阻断T细胞抑制或激活T细胞共受体和对肿瘤微环境的改善。联合策略在一些患者治疗中表现出疗效,表明对单个患者的肿瘤状态和免疫情况值得更深入的研究(图2)。
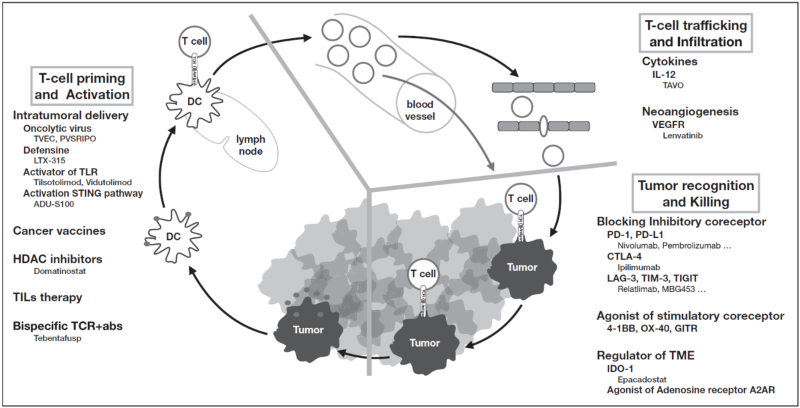
图2. 肿瘤免疫循环中三个主要药物免疫调节位点[2]。Che和Mellman提出的肿瘤免疫循环分为三个主要步骤。图中列出了转移性黑色素瘤患者在临床试验中使用的各种药物。大多数的新策略都旨在促进T细胞启动或增强T细胞对肿瘤的识别和杀伤。
-
肿瘤的识别与杀伤
肿瘤浸润性淋巴细胞 (Tumor Infiltrating Lymphocytes, TILs)功能障碍可能是因为肿瘤细胞或免疫抑制细胞(如Treg或MDSCs)分泌的因子,产生免疫抑制的肿瘤微环境所致。此外,T细胞可能表达PD-1和CTLA-4以外的其他抑制性共受体,或携带激活性共受体。靶向这些备选检查点可以逆转T细胞衰竭(图3)。
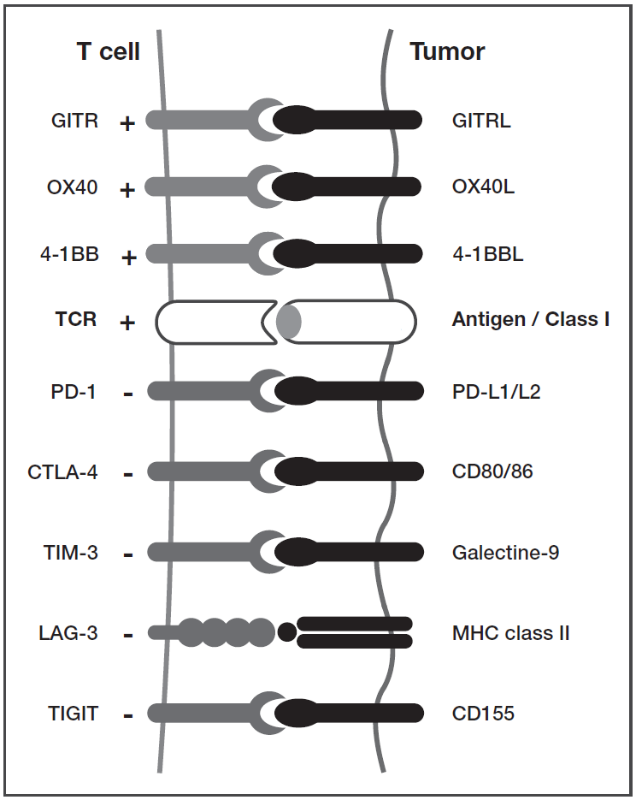
图3.在临床试验中,单克隆抗体可靶向T细胞抑制和共激活受体。T细胞通过其肿瘤细胞受体与HLA I类分子提呈的特定抗原结合来识别肿瘤。这种激活的微调是由几个激活性或抑制性共受体的相互作用完成的。
靶向T细胞共刺激受体策略
一种策略是利用激动性抗体激活T细胞共激活受体。包括OX-40、GITR和4-1BB单药或与ICIs联合使用。TCR激活后,这些受体在T细胞上上调。值得注意的是,根据TME的不同,靶向OX-40和GITR可能对Treg产生影响,削弱它们的抑制活性,因为它们也在激活的Treg上高度表达,因此可以被ADCC清除[3-5]。目前,有几项针对晚期实体瘤(包括黑色素瘤)的单药或联合PD-1/PD-L1或4-1BB激动剂抗体的研究正在进行中。LVGN6051是礼进生物开发的经Fc工程改造的4-1BB激动性单抗,目前正在与PD-1抗体 pembrolizumab联合治疗转移性黑色素瘤,初步观察到令人鼓舞的结果(NCT04130542,NCT04694781)(图4)。
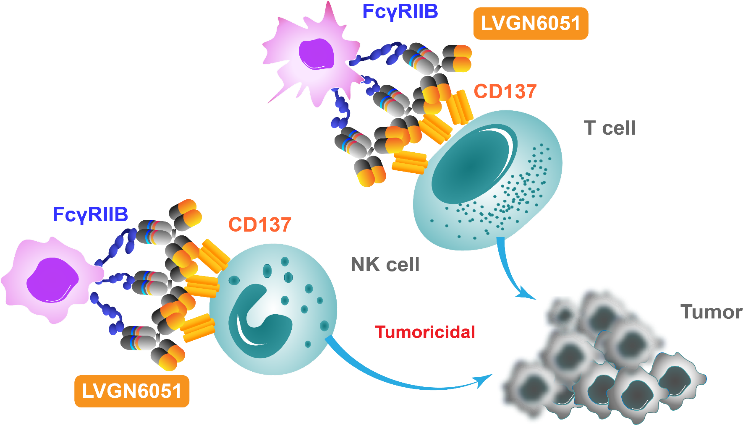
LVGN6051是一种抗CD137(也称4-1BB或TNFRSF9)的单克隆抗体,经工程改造的Fc特异性结合FcγRIIB,选择性在肿瘤微环境中激活免疫反应[6]。
本文仅作信息分享,不代表礼进生物公司立场和观点,也不作治疗方案推荐和介绍。如有需求,请咨询和联系正规医疗机构。
参考文献:
1. Gide, T.N., et al., Primary and Acquired Resistance to Immune Checkpoint Inhibitors in Metastatic Melanoma. Clinical Cancer Research, 2018. 24(6): p. 1260-1270.
2. Devaux, A. and J.-F. Baurain, Management of metastatic melanoma with new immunotherapy approaches beyond PD-1/CTLA-4 inhibitors. Current Opinion in Oncology, 2022. 34(2): p. 123-130.
3. Aspeslagh, S., et al., Rationale for anti-OX40 cancer immunotherapy. Eur J Cancer, 2016. 52: p. 50-66.
4. Willoughby, J., et al., OX40: Structure and function - What questions remain? Mol Immunol, 2017. 83: p. 13-22.
5. Zhu, M.M.T., et al., Evaluation of glucocorticoid-induced TNF receptor (GITR) expression in breast cancer and across multiple tumor types. Mod Pathol, 2020. 33(9): p. 1753-1763.
6. Qi, X., et al., Optimization of 4-1BB antibody for cancer immunotherapy by balancing agonistic strength with FcγR affinity. Nature Communications, 2019. 10(1): p. 2141.
-





 沪公网安备 31011502015333号
沪公网安备 31011502015333号