

科普文章
胃癌免疫治疗新思路:PD-1抗体联合4-1BB激动剂的新辅助疗法
1. 胃癌免疫治疗新时代[1]
免疫检查点抑制剂(ICIs),如程序性细胞死亡1 (PD-1)或程序性细胞死亡配体1 (PD-L1)单克隆抗体在多种恶性肿瘤中有效延长了患者生存期,包括晚期胃癌患者(Advanced gastric cancer, AGC)。Nivolumab是一种PD-1单克隆抗体,对未经选择的AGC患者进行后线治疗(ATTRACTION-2),或联合化疗作为一线治疗时(CheckMate-649)患者总生存期都得到显著改善。另一种PD-1单克隆抗体pembrolizumab在高频微卫星不稳定性(MSI-H)或高肿瘤突变负荷(TMB)的肿瘤中显示单药活性。此外,最近的一项KEYNOTE-811研究显示,pembrolizumab联合trastuzumab(赫赛汀)和化疗对HER2阳性AGC的治疗应答率有显著改善。基于以上关键临床试验结果,ICIs现在被纳入AGC患者的标准治疗方案。
三种PD-1抗体被批准用于AGC治疗:1)在亚洲,nivolumab联合化疗作为一线治疗或nivolumab单药治疗作为三线或后线治疗;2)在美国,pembrolizumab用于先前已治疗的高微卫星不稳定(MSI-H)或高肿瘤突变负荷的AGC,或pembrolizumab联合trastuzumab和化疗治疗HER2阳性AGC;3)dostarlimumab用于美国先前已治疗的MSI-H AGC。
然而,大量患者对ICIs表现出耐药性,提示患者选择和进一步联合免疫治疗的重要性。这篇综述集中阐述分子和免疫学的概况,ICIs的关键临床试验与相关的生物标志物,以及AGC的免疫治疗研究[1]。

图1.晚期胃癌免疫治疗的现状。CPS: PD-L1联合阳性评分;T-DXd:trastuzumab deruxtecan[1] 。
PD-1抗体联合常规药物的一线治疗临床试验显示,对HER2阴性和HER2阳性AGC患者均具有临床活性。然而,nivolumab联合化疗在PD-L1表达较高(CPS≥5)的HER2阴性AGC中更有效,目前尚不清楚该联合治疗仅适用于CPS≥5的人群,还是可以不考虑PD-L1 CPS。目前,FDA和亚洲国家(中国、韩国和日本)的监管机构已批准nivolumab与化疗联合使用,而不考虑PD-L1 CPS。EMA和NCCN指南已批准或推荐其用于CPS≥5的AGC。鉴于生物标志物与临床结果的密切相关性,我们认为应继续充分调查研究PD-L1 CPS和MSI情况。
此外,单独化疗也应作为一种治疗选择,一方面与常规药物相比,PD-1抗体加化疗的TRAEs增加;另一方面考虑到患者的基本情况:并发症(如自身免疫疾病)和家庭支持,特别是CPS<5的病人(表1)。
鉴于获得ICIs临床疗效的患者数量有限,迫切需要开发新的免疫疗法。目前,ICIs加上其他靶向药物,如多激酶抑制剂和cldn18.2特异性CAR-T细胞疗法,在早期临床试验中似乎很有前景,需要在后续研究中进一步评估。
2. PD-1抗体作为新辅助治疗方案,PD-1抗体联合4-1BB激动剂抗体较PD-1抗体单一治疗疗效更佳
临床试验表明,无论是否使用常规化疗,PD-1抑制剂作为新辅助疗法,在多种恶性肿瘤中表现出良好的抗肿瘤活性。在胃癌中,两项III期KEYNOTE-585 (NCT03221426)和MATTERHORN (NCT04592913)试验正在评估在围手术期化疗中添加PD-1/PD-L1抗体的疗效。此外,在辅助疗法中,一项III期试验ATTRACTION-5(NCT03006705)正在研究S-1或capecitabine + oxaliplatin联合nivolumab对D2或淋巴结广泛清除后病理性III期胃癌(包括食管胃结合部癌)患者的标准辅助化疗。临床前模型和近期的临床试验结果表明,联合治疗可能是提高疗效和广泛适用的癌症免疫治疗所必需的。
CD137是一种选择性表达于活化T细胞和自然杀伤(NK)细胞上的共刺激受体。CD137抗体在小鼠肿瘤模型研究中表现出优异的抗肿瘤能力。此外,在临床试验中,CD137抗体也显示出良好的疗效,目前正在对多种实体瘤和血液恶性肿瘤进行联合试验,包括LVGN6051(4-1BB 激动性单抗)联合pembrolizumab (NCT04130542)和GEN1046(PD-L1/4-1BB 双特异性抗体)联合pembrolizumab (NCT03917381)。
在三阴性乳腺癌小鼠模型中,与原发肿瘤切除后辅助治疗相比,PD-1抗体联合CD137单克隆抗体的新辅助治疗可增加肿瘤抗原特异性CD8+ T细胞的数量,并提高生存率[2]。在两个自发转移的小鼠模型中证实了新辅助PD-1抗体联合CD137抗体的抗肿瘤能力优于PD-1抗体单一用药(图2)。值得注意的是, 4T1.2是高自发转移肿瘤,普遍认为一旦原发肿瘤形成就极难根除。与4T1.2肿瘤模型不同(图2A),单独的PD-1抗体辅助治疗是无效的,新辅助PD-1抗体并不能延长总生存期(图2D)。相比之下,与使用辅助CD137抗体组相比,单独使用新辅助CD137抗体组显著延长了小鼠的生存期(图2D)。
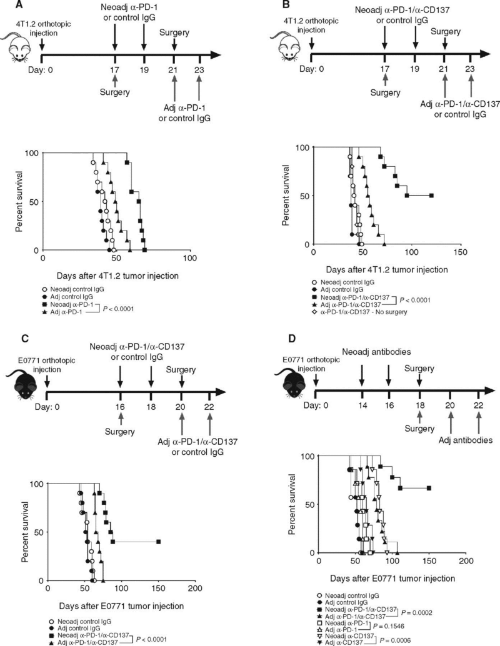
图2.新辅助治疗较辅助治疗的PD-1抗体联合CD137抗体治疗更有效地根除肿瘤转移[2]。
3. PD-1抗体联合4-1BB激动剂抗体的免疫治疗依赖CD8+ T细胞和IFNγ
Liu, J.等人接下来使用靶基因小鼠或消耗/中和抗体检测了参与新辅助PD-1抗体联合CD137抗体治疗的效应信号通路和免疫细胞(图3)。在4T1.2和E0771肿瘤模型中,新辅助治疗的疗效依赖于IFNγ,因为在被中和后无法延长小鼠生存期(图3A和B)。穿孔素的消耗对新辅助免疫治疗的疗效没有太大影响,因为相当比例的小鼠仍能长期存活(图3A和B)。实验还表明,三种类型免疫细胞CD8、CD4和NK细胞都是必需的,而且CD8似乎比其他亚群更重要(图3C)。

图3.新辅助免疫治疗的疗效取决于CD8+ T细胞和IFNγ[2]。
4. PD-1抗体联合4-1BB激动剂抗体免疫治疗增加了外周血和器官中肿瘤特异性CD8+T细胞
Liu, J.等人接下来剖析了新辅助免疫治疗较辅助治疗诱导更优抗肿瘤免疫的机制。考虑到CD8+ T细胞在4T1.2和E0771肿瘤模型中的重要性,Liu, J.等人首先通过检测肿瘤反应性gp70四聚体特异性CD8+ T细胞比例是否发生改变。在新辅助PD-1抗体联合4-1BB抗体治疗后,观察到血液和器官中肿瘤特异性CD8+ T细胞的大量增加(图4)。
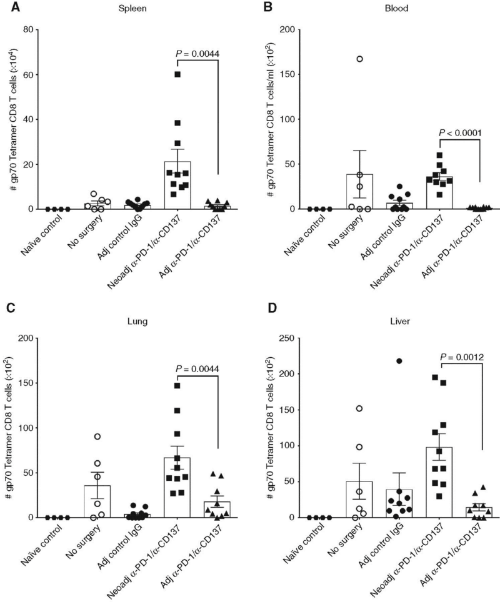
图4.新辅助PD-1抗体联合4-1BB抗体治疗致使外周血和器官中gp70肿瘤特异性CD8+ T细胞的全身性扩增[2]。
5. 肿瘤特异性CD8+ T细胞是预后的生物标志物
Liu, J.等人观察到,在新辅助免疫治疗后的早期,检测到血液中肿瘤特异性CD8+ T细胞水平较高的小鼠预计可以长期存活(图5)。在接受新辅助治疗的PD-1抗体联合4-1BB抗体组中,大多数在第14或15天(即新辅助治疗后4天)显示肿瘤特异性CD8+ T细胞水平最高的小鼠存活超过100天,并通常可以长期存活。还观察到血液中gp70肿瘤特异性CD8 + T细胞在这些小鼠的体内保持了效应记忆或中央记忆特性(图5D和E)。
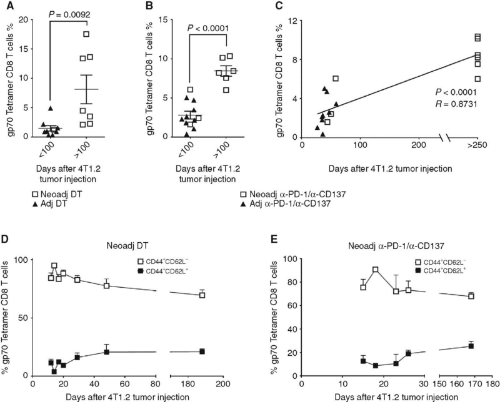
图5.肿瘤特异性CD8+ T细胞是预后的生物标志物[2]。A和B:在接受新辅助(neoadj)或辅助(adj)免疫治疗(视情况而定)后4天来自单个小鼠的gp70四聚体+ CD8+ TCRβ+细胞水平,根据它们在4T1.2细胞注射后存活时间的长短进行分组。C:接受新辅助或辅助PD-1/CD137抗体治疗后4天,单个小鼠gp70四聚体+ CD8+ TCRβ+细胞水平与生存期的线性回归及相关性。A-C,每个符号代表一只小鼠;数据来自图3D。数据来自两个实验,在肿瘤形成后存活时间小于或大于100天的组之间有显著差异。D和E:如图3D所示,在相同的实验中,圈选淋巴细胞中活的CD45.2+细胞,显示了外周血中gp70四聚体+ CD8+ TCRβ+ T细胞的比例,即CD44+ CD62L−或CD44+ CD62L+。
6. 讨论
Liu, J.等人的研究证明:新辅助PD-1抗体联合4-1BB激动剂抗体免疫治疗在两种三阴性乳腺癌手术切除后的临床前模型中改善肿瘤清除的疗效 [2]。利用4T1.2和E0771两种自发原位肿瘤模型,充分评估了新辅助对比辅助治疗中的手术和致死性转移情况。此外,尽管在两种乳腺癌临床前模型中已经清楚地证明了新辅助治疗比辅助免疫治疗更有效,但仍需在其他不同组织来源的肿瘤中证实这些发现。
尽管CTLA4 抗体联合PD-1抗体是目前FDA批准的唯一一种联合免疫疗法,但关于PD-1抗体和CD137抗体的研究结果为在新辅助治疗中测试这种组合提供了夯实的证据。LVGN6051(4-1BB激动性Fc工程改造单抗)与PD-1抗体和其他组合目前正在一些临床试验中对晚期实体瘤(NCT05301764, NCT04130542, NCT04694781, NCT05075993和NCT04635995)进行测试。从临床前模型和最近的临床试验中可以明显看出,联合治疗可能是最有效和广泛适用的癌症免疫治疗手段。
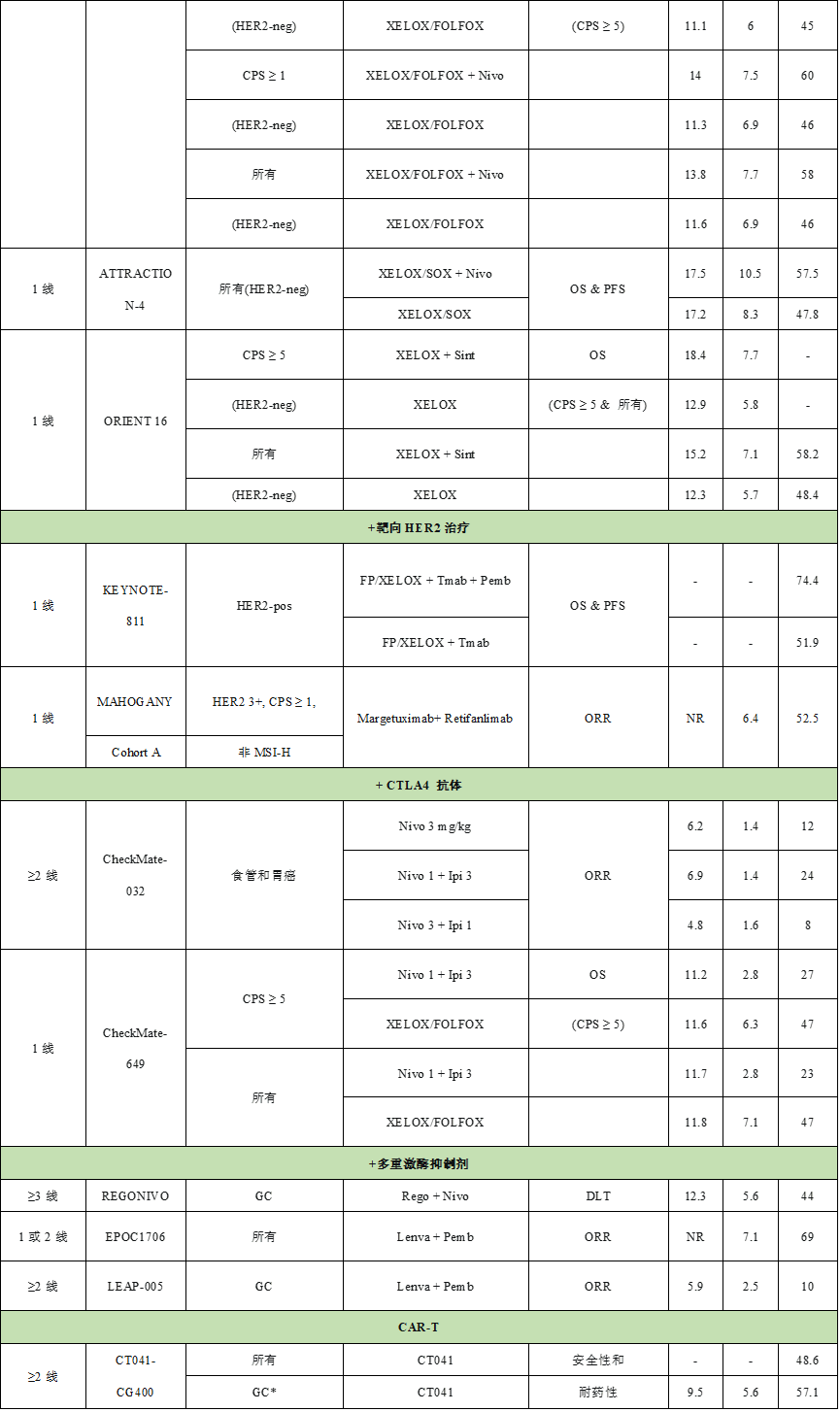
表1.下表列出了PD-1/PD-L1抗体治疗胃癌的关键临床试验[1]。

本文仅作信息分享,不代表礼进生物公司立场和观点,也不作治疗方案推荐和介绍。如有需求,请咨询和联系正规医疗机构。
参考文献:
1. Takei, S., A. Kawazoe, and K. Shitara, The New Era of Immunotherapy in Gastric Cancer. Cancers, 2022. 14(4): p. 1054.
2. Liu, J., et al., Improved Efficacy of Neoadjuvant Compared to Adjuvant Immunotherapy to Eradicate Metastatic Disease. Cancer Discovery, 2016. 6(12): p. 1382-1399.
3. Kershaw, M.H., et al., Gene-Engineered T Cells as a Superior Adjuvant Therapy for Metastatic Cancer1. The Journal of Immunology, 2004. 173(3): p. 2143-2150.








 沪公网安备 31011502015333号
沪公网安备 31011502015333号