

学习资源
科普文章
新一代 T 细胞接合剂 (T-cell engagers,TCE)
在过去的几十年里,癌症治疗手段不断更新,其中包括基于 CD3 的双/多特异性 T 细胞接合剂 (T-cell engagers,TCE) 的开发。与传统单抗不同,TCE通过结合一个或多个肿瘤抗原表位,条件性激活病人本身T细胞,增强其对肿瘤的杀伤作用,从而达到治疗癌症的目的。TCE分子有多种构型(format),并可根据适应症特点(如肿瘤抗原的选择)进行设计。
我们将选择性地介绍几例TCE,希望可以为新一代 TCE 分子的开发提供思路。
系列二:Tecvayli,强生BCMA/CD3双特异性抗体
Tecvayli(Teclistamab)是通过DuoBody技术平台(Genmab)构建的1+1非对称IgG4双特异性抗体,将CD3 T细胞重定向到表达BCMA的骨髓瘤细胞,以诱导针对靶细胞的细胞毒作用。通过对Fc段的S228P/L234A/L235A沉默突变,消除了Fc依赖的免疫效应功能。用于治疗复发/难治性多发性骨髓瘤(relapsed/refractorymultiple myeloma,RRMM)。
2022年10月25日,强生旗下杨森制药公司宣布,美国食品药品监督管理局(FDA)已批准BCMA/CD3双特异性抗体Tecvayli(Teclistamab)上市,用于治疗复发或难治性多发性骨髓瘤成人患者,这些患者之前至少接受过四种治疗疗法,包括蛋白酶体抑制剂、免疫调节剂和抗CD38单克隆抗体。
2022年8月25日,欧盟EMA批准了BCMA/CD3双特异性抗体Tecvayli有条件上市,适应症为单药治疗复发/难治性多发性骨髓瘤(RRMM)成人患者。条件批准主要基于其 I/II 期临床试验NCT03145181和NCT04557098,研究Tecvayli在165名复发/难治性多发性骨髓瘤患者中的疗效和安全性。
表1. Tecvayli (Teclistamab) 一栏表 [1]
1. Teclistamab作用机制
Teclistamab是一种人源化的IgG4-PAA双特异性抗体(Genmab,DuoBody),可同时结合T细胞表面CD3e抗原和B细胞成熟抗原(BCMA),介导T细胞和肿瘤细胞的交联,诱导细胞毒性T淋巴细胞对骨髓瘤细胞的裂解反应[1]。

图1.Teclistamab作用机制[1]
1.1. 多发性骨髓瘤
多发性骨髓瘤(multiple myeloma,MM)是一种恶性浆细胞疾病,其特征是骨髓中终末分化的浆细胞(BM)恶性增殖,导致骨病变。伴有单克隆免疫球蛋白或轻链(M蛋白,异常蛋白)过度生成。多发性骨髓瘤常导致多发性溶骨性损害、高钙血症、贫血、肾脏损害。由于正常免疫球蛋白的生成受抑,因此容易出现各种细菌性感染。发病率约占所有血液肿瘤的10%。
1.2. BCMA
B细胞成熟抗原(B-cell maturation antigen ,BCMA/CD269/ TNFRSF17)为20 kDa的跨膜受体,在B细胞谱系中选择性表达,广泛表达于多发性骨髓瘤细胞。在与诱导增殖的配体APRIL(CD256)和BAFF (CD257)结合后,激活p38/NF-Kb,诱导抗凋亡蛋白上调以调节B细胞成熟、增殖和生存。γ-分泌酶催化BCMA跨膜结构域断裂,产生的可溶形式的BCMA (sBCMA)增加,与MM患者的疾病进展和较短的总生存期正相关。
1.3. Teclistamab 临床前研究
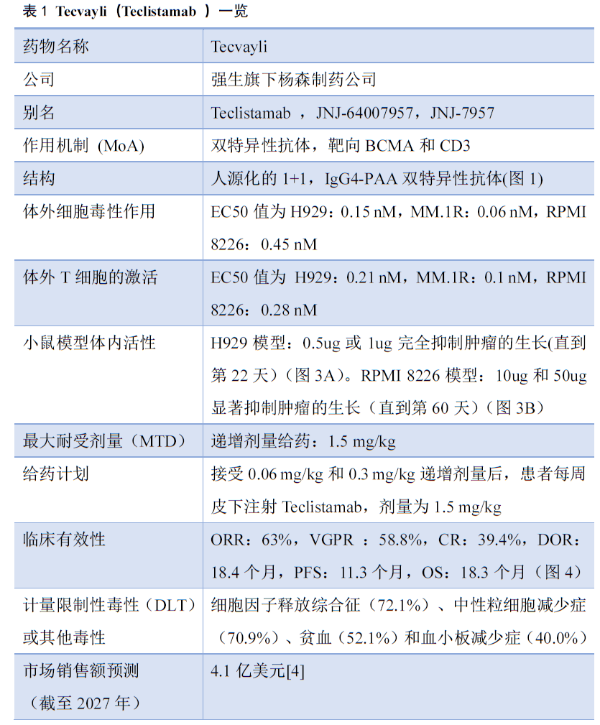
临床前体外研究发现,Teclistamab介导了T细胞对BCMA+细胞系的细胞毒性作用(EC50值为H929:0.15 nM,MM.1R:0.06 nM,RPMI 8226:0.45 nM),而对BCMA-细胞系MV4-11没有引起杀伤作用(图2A)。
T细胞与BCMA+细胞共培养后,通过检测CD25+T细胞的量,观察到Teclistamab诱导了T细胞的激活(EC50值为 H929:0.21 nM,MM.1R:0.1 nM,RPMI 8226:0.28 nM),当T细胞与BCMA-细胞培养时,未观察到T细胞的活化(图2B)。
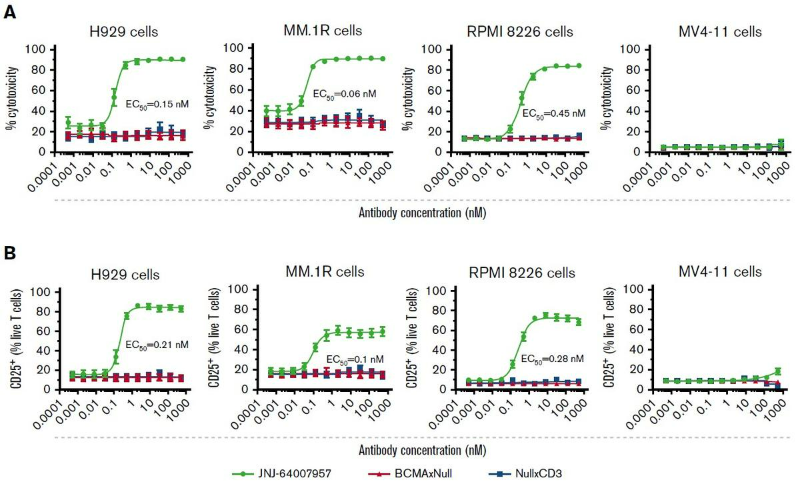
图2. Teclistamab介导的体外细胞毒性(A)和T细胞激活作用(B) [1]
移植小鼠模型体内活性研究中,在H929模型中,与PBS对照相比,0.5ug或1ug剂量的Teclistamab完全抑制了肿瘤的生长(直到第22天)(图3A)。而0.1ug Teclistamab,BCMAxNull和NullxCD3对肿瘤的抑制能力很弱。在RPMI 8226模型中,与PBS对照相比,10ug和50ug剂量的Teclistamab显著抑制了肿瘤的生长(直到第60天)(图3B)。
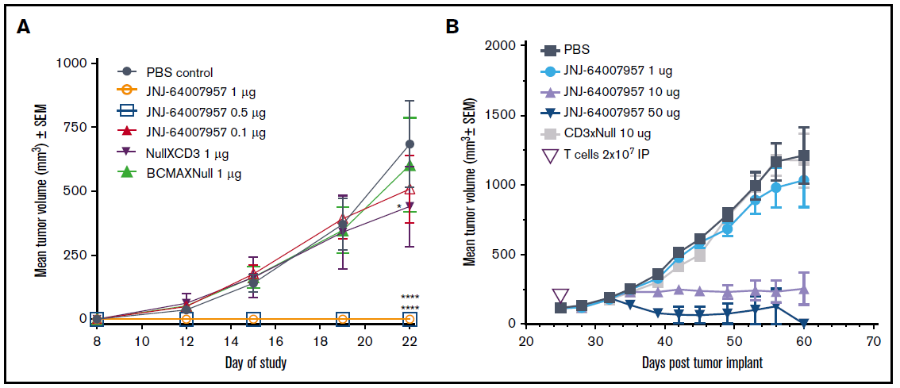
图3. Teclistamab在移植小鼠模型中的抗肿瘤活性[1]
(A:H929小鼠模型, B:RPMI8226小鼠模型)
2. Teclistamab治疗RRMM的有效性和安全性
Teclistamab的有效性和安全性正在进行的MajesTEC-1临床试验(非随机、开放标签、多中心)中进行了测试,该试验分为两个阶段,第一阶段(NCT03145181)和第二阶段(NCT04557098)。此项I/II期研究纳入了至少接受三线治疗(包括三类药物:免疫调节药物、蛋白酶体抑制剂和抗CD38抗体)后的复发或难治性骨髓瘤患者。接受0.06 mg/kg和0.3 mg/kg递增剂量后,患者每周皮下注射Teclistamab(剂量为1.5 mg/kg)。主要终点是总体缓解(部分缓解或更好疗效)[2]。
2.1 疗效
在接受Teclistamab治疗的165例患者中 (40例被纳入1期研究,125例被纳入2期研究),77.6%患三类药物均难治的疾病(中位数,既往接受过五线治疗)。试验结果显示,在中位随访时间为14.1个月时,总客观缓解率(ORR)达到63%,58.8%的患者获得很好的部分缓解或更好缓解(VGPR),39.4%的患者达到完全缓解(CR)或更好缓解(图4)。共计44例患者(26.7%)被发现无微小残留病变(MRD);在达到完全缓解或更好疗效的患者中,MRD阴性率为46%。中位持续缓解时间(DOR)为18.4个月,中位无进展生存期(PFS)为11.3个月,中位总生存期(OS)为18.3个月(图4)[2]。
2.2 安全性
在接受治疗的165例病人中,156例(94.5%)病人出现3级或4级不良反应,常见不良事件包括细胞因子释放综合征(72.1%;3级:0.6%;无4级事件)、中性粒细胞减少症(70.9%;3级或4级:64.2%)、贫血(52.1%;3级或4级:37.0%)、血小板减少症(40.0%;3级或4级:21.2%)。感染的发生率高(76.4%;3级或4级:44.8%)。24例患者(14.5%)发生神经毒性事件,包括5例患者的免疫效应细胞相关神经毒性综合征(3.0%;全部为1级或2级)(图5)。
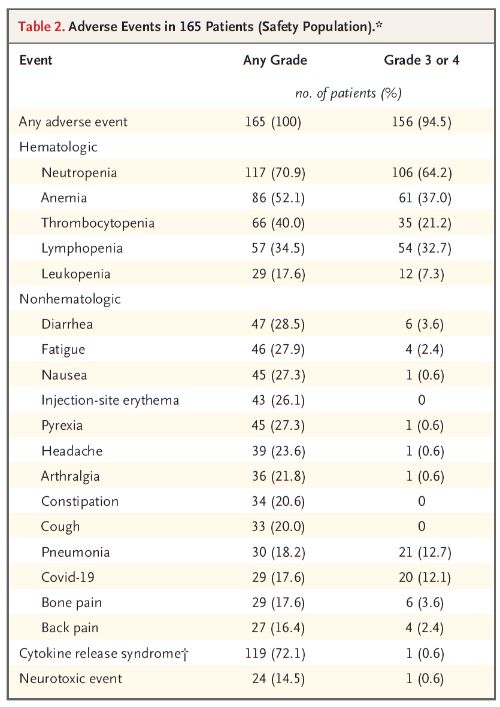
图5.165例病人的不良反应研究[2]
2.3 免疫原性、生物标志物和药代动力学
在接受推荐的2期剂量并且免疫原性可以评估的146例患者中,未发现抗Teclistamab抗体。
可溶性BCMA的血清水平被作为肿瘤负荷和缓解情况的潜在标志物进行评估。正如预期,与缓解较差的患者相比,在缓解较好的患者中,可溶性BCMA水平降低较多。
在给予Teclistamab后观察到了细胞因子和T细胞活化的药效学诱导。在治疗应答和细胞因子水平或T细胞活化的最大变化之间,未观察到显著关联。然而,对治疗有应答的患者与无应答的患者相比,干扰素γ、白介素-6、白介素-10和白介素-2受体α的水平较高。在他们的CD8+ T细胞上,CD38或T细胞免疫球蛋白和含有黏蛋白结构域的蛋白3水平也较高,这提示在开始治疗后较早发生的免疫活化可能是临床应答的一个预测因素。
3. 商业信息
Teclistamab由丹麦Genmab公司开发,作为2012年7月执行的DuoBody专利技术平台协议的一部分,Genmab公司将其授权给强生公司。根据协议条款,Genmab和强生将合作研究多达10个DuoBody项目,Genmab将从强生获得350万美元(2100万丹麦克朗)的预付款,Genmab的所有研究将由强生全额资助。此外,Genmab将有可能获得每款产品的里程碑和许可证支付约1.75亿美元(10.62亿丹麦克朗),以及商业化产品的版税[3]。
根据2022年nature review上报道的关于肿瘤治疗的双特异性抗体未来销售额预测研究,目前全球研发BCMA×CD3双特异性抗体用于治疗RRMM的药物,主要有辉瑞的Elranatamab和强生的Teclistamab,截至到2027年,Elranatamab预计将是最畅销的bsAb,销售额将达到6.65亿美元,Teclistamab的销售额有望达到4.1亿美元(图6)[4]。
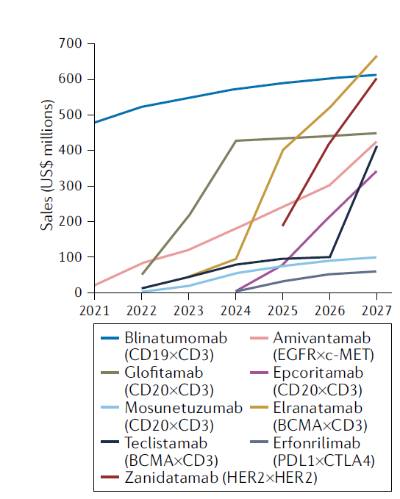
图3. 部分双特异性抗体未来销售额预测
4. 总结
过去十年,蛋白酶体抑制剂、免疫调节药物和单克隆抗体药物的使用,使多发性骨髓瘤疾病得到了一定程度控制,长期生存期得到改善。尽管有这些治疗方式,几乎所有的患者最终都会复发,并对现有的治疗方法产生耐药性。亟需新的治疗药物开发为复发/难治性患者提供治疗选择。
在这项1/2期研究中,Teclistamab对既往接受过大量治疗的复发或难治性多发性骨髓瘤患者具有显著的临床活性。不良事件,包括低级别细胞因子释放综合征和3级或4级血细胞减少,以及感染。同时,我们观察到虽然CRS得到了很好的控制,但是血液毒性存在安全隐患,仍有空间开发更安全及有效的BCMA TCE。
另外,BCMA的细胞治疗近年来也发展迅速。嵌合抗原受体(CAR) T细胞是一种利用自体工程T细胞进行抗肿瘤治疗的新型细胞疗法。首个用于复发性MM的CAR - T产品idecabtagene vicleucel (ide-cel)于2021年获批,用于既往接受过4种或4种以上静脉注射的患者,包括IMiD、PI和cd38靶向的MoAb。由于大多数MM细胞缺乏CD19, ide-cel是一种BCMA导向的CAR - T,具有4-1BB共刺激结构域。idel -cel的一项1期研究显示,对RRMM的疗效与剂量相关,随着注入细胞数量的增加,反应的深度和持续时间都在改善。128例MM患者在接受PI、IMiD和抗cd38 MoAb治疗后进展,idecel的总缓解率为73%,其中33%在150-450 x 106 CAR - T细胞/kg剂量范围内实现完全缓解。在450x106 CAR - T细胞/kg的靶剂量下,idecel的总有效率为83%,无进展生存期为12.1个月。目前正在进行伊德赛与其他RRMM标准治疗方案的三期比较研究。
2022年初,另一种具有4-1BB共刺激结构域的BCMA靶向CAR - T产品ciltacabtagene autoleucel (cilta-cel)成为第二种被批准用于RRMM的CAR - T产品,适应证与ide-cel类似。Cilta-cel可能比idecel有更好的活性,这可能是由于它的二价结合区。在一项cilta-cel的1/2期研究中,在既往6种治疗方案中位的MM患者中,0.75x106 CAR - T细胞/kg的目标剂量的总体应答率为98%。12个月无进展生存率为77%,1年生存率为89%。Cilta-cel目前也正在进行一些临床试验,以探索更多的临床环境。[5]
我们注意到BCMA的CART普遍有加入4-1BB共刺激靶点下游信号通路,以提升T细胞长期存活率和抑瘤效率。这也为礼进生物的管线开发提供更多信心,礼进生物基于自研的交联依赖性抗体平台 xLinkAb的开发的靶向4-1BB激动剂单抗LVGN6051,单药和联合治疗的临床I/II期试验正在中国和美国同步开展,其安全性和活性初步在多项临床前和临床试验中得到验证。目前正积极推进BCMA/CD3/4-1BB的三抗TCE研究,临床前试验表现出优于BCMA/CD3双抗的抗肿瘤和安全特性。目前公司正在积极寻求技术转让和合作开发机会。
本文仅作信息分享,不代表礼进生物公司立场和观点,也不作治疗方案推荐和介绍。如有需求,请咨询和联系正规医疗机构。
参考文献:
1. Pillarisetti, K., et al., Teclistamab is an active T cell-redirecting bispecific antibody against B-cell maturation antigen for multiple myeloma. Blood Adv, 2020. 4(18): p. 4538-4549.
2. Moreau, P., et al., Teclistamab in Relapsed or Refractory Multiple Myeloma. N Engl J Med, 2022. 387(6): p. 495-505.
3. Globenewswire, Genmab Enters Broad Collaboration with Janssen Biotech, Inc. for DuoBody Platform. Press Release, 2012.
4. Esfandiari, A., S. Cassidy, and R.M. Webster, Bispecific antibodies in oncology. Nat Rev Drug Discov, 2022. 21(6): p. 411-412.
5. Swan D, Routledge D, Harrison S. The evolving status of immunotherapies in multiple myeloma: the future role of bispecific antibodies. Br J Haematol. 2022 Feb;196(3):488-506.








 沪公网安备 31011502015333号
沪公网安备 31011502015333号