

学习资源
科普文章
新一代 T 细胞接合剂 (T-cell engagers,TCE)
在过去的几十年里,癌症治疗手段不断更新,其中包括基于 CD3 的双/多特异性 T 细胞接合剂 (T-cell engagers,TCE) 的开发。与传统单抗不同,TCE通过结合一个或多个肿瘤抗原表位,条件性激活病人本身T细胞,增强其对肿瘤的杀伤作用,从而达到治疗癌症的目的。TCE分子有多种构型(format),并可根据适应症特点(如肿瘤抗原的选择)进行设计。
我们将选择性地介绍几例TCE,希望可以为新一代 TCE 分子的开发提供思路。
系列一:Glofitamab,罗氏CD20/CD3双特异性抗体
Glofitamab是一种IgG1类结构、Fc段沉默(silence)、具有独特2:1结构的CD20/CD3双特异性抗体,同时与B细胞CD20和T细胞CD3结合,诱导T细胞的激活和针对恶性肿瘤B细胞的免疫反应,从而实现抗肿瘤效应。
表1. Glofitamab 一栏表 [1]
1. 结构特征
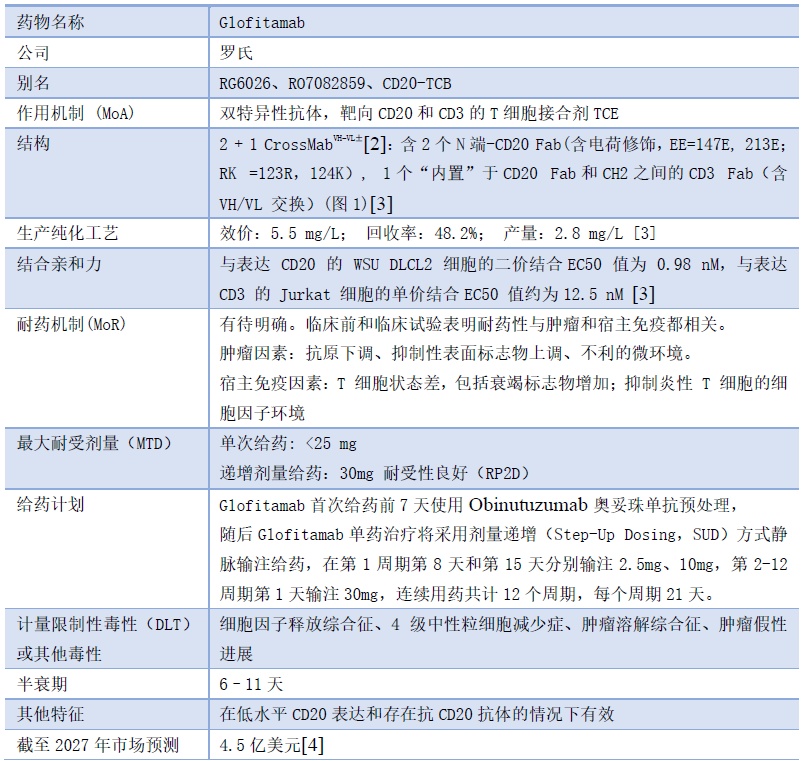
Glofitamab是一种基于IgG1 Fc结构,新型2:1 Fab的全长型双特异性抗体,包括两个CD20结合结构域和一个CD3结合结构域(图1),其中一个CD20 Fab区与CD3 Fab区由连接器(linker)连接。这种结构增加了CD20结合价,并促进了表达CD20的肿瘤细胞和表达CD3的T细胞间形成更紧密的突触(synapse),提高T细胞对肿瘤细胞的杀伤效果。临床前研究显示,相较于1:1结构,Glofitamab在体外肿瘤杀伤的平均水平增加了40倍。这使得Glofitamab即使在先前或同时服用靶向CD20的单抗药物的情况下依然有效,有利于仍需服用CD20单抗药物的复发患者,或者利用CD20单抗预处理来降低细胞因子风暴不良反应的给药策略。
Glofitamab具有IgG1类结构,并在重链区引入“PG LALA”的突变,使Fc片段无法与Fc受体或C1q结合,防止Glofitamab因抗体依赖细胞介导的细胞毒性作用(ADCC效应)和补体依赖的细胞毒性作用(CDC效应)被清除。同时,保留了Fcγn结合能力,允许Glofitamab参与内源性抗体循环。以上策略使得Glofitamab半衰期在6-11天之间,允许临床间歇给药。
IgG类结构的缺点是分子量较大,可能导致肿瘤渗透能力较差;另外由于“2+1”结构较为复杂,分子成药性有一定挑战。
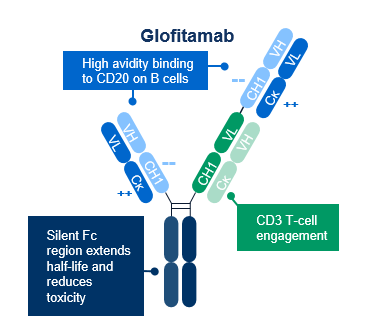
图 1 glofitamab 的结构[5]
2. 作用机制
CD20结合结构域来源于高亲和力的Type II CD20抗体obinutuzumab奥妥珠,结合CD20蛋白的细胞外部分 (图2)。T细胞结合域识别CD3e链,这是TCR的信号转导子成分,与T细胞结合激活T细胞,不受TCR特异性或MHC亚型限制,也不依赖共刺激信号。通过该信号通路的激活促进细胞因子释放、T细胞增殖和对肿瘤细胞的直接细胞毒性。与高亲和力CD20结合结构域相比,CD3e结合是单价的,亲和力较低,旨在限制非特异性免疫激活和相关副作用。
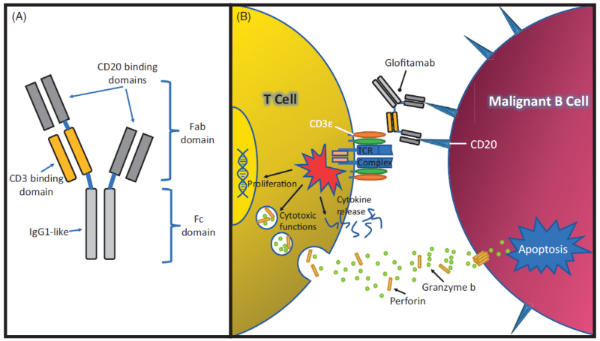
图2. Glofitamab 分子机制
临床前实验也验证了该机制:利用体外动态成像系统,将表达CD20的淋巴瘤细胞 (WSU-DLCL2),预激活的细胞毒性CD8 T细胞,荧光标记CD20-TCB三者共培养,可视化抗体结合和肿瘤细胞裂解过程。研究发现,CD20-TCB显著降低了T细胞的运动速度,增加肿瘤与T细胞接触面积,进而延长了肿瘤细胞与T细胞之间的相互作用。在4小时内观察到多个T细胞对单个靶细胞的杀伤作用。对不同的时间点采集的样品进行流式细胞分析证实了T细胞的激活和扩增与肿瘤杀伤作用,其中CD4和CD8 T细胞亚群均增加,并且CD8 T细胞增殖较强于CD4 T细胞。
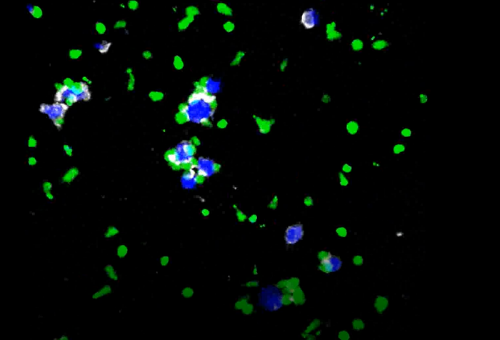
视频1. Glofitamab介导T细胞杀伤肿瘤
Glofitamab:白色,CD8+ T细胞:绿色,肿瘤细胞:蓝色
3. 临床药效
Glofitamab作为单一药物或与obinutuzumab联合治疗复发或难治性B-NHL的1期剂量增加和剂量拓展研究中(NCT03075696),单次给药Obinutuzumab预处理后,开始使用Glofitamab,给药剂量从5 μg到30mg不等,持续12个周期。所有剂量水平的171例患者的结果已经公布,其中包括35例接受二期推荐剂量(RP2D)的患者。主要剂量限制毒性为≥2级细胞因子释放综合征(3.5%),4级中性粒细胞减少症(1.2%)和3级肿瘤溶解综合征(1.2%)。所有患者的完全缓解 (CR)率为36.8%、侵袭性 B-NHL (aNHL)的·CR 为33.1%、弥漫性大 B 细胞淋巴瘤 (DLBCL) 的 CR为28.8%,以及滤泡性淋巴瘤 (FL)的CR为7.7%。 根据13.5个月随访统计,滤泡性淋巴瘤患者的无进展生存期 (PFS)和缓解持续时间分别为11.8个月和10.8个月,侵袭性 B-NHL患者的PFS为2.9 个月而缓解持续时间为5.5 个月。本研究纳入的患者平均接受过3种既往治疗,其中100%对化疗耐药,84.2%对CD20靶向治疗耐药。
2022年ASCO年会上罗氏发布了II期NP30179(NCT03075696)扩展研究数据,该研究是针对高度难治性DLBCL患者的,其中58.3%的患者对初始治疗无效,约1/3(33.1%)的患者之前接受过CAR -T细胞治疗。根据12.6个月随访,39.4%的患者(n=61/155)达到CR(主要疗效终点),其中一半患者(51.6%;N =80/155)获得了总体缓解(部分或完全缓解的患者的百分比;次要疗效终点)。大多数(77.6%)在12个月时病情得到持续的完全缓解,中位持续时间尚未达到。63.0%的患者发生细胞因子释放综合征(CRS)。CRS事件是可预测的,通常是低级别(主要是1级[47.4%]或2级[11.7%]),发生在初始剂量,只有1例患者因CRS停用Glofitamab,3级以上CRS发生率较低(3.9%),无5级CRS。
4. 安全性和毒性
TCE和其他T细胞免疫疗法一样,存在免疫过激可能引起的毒性,是临床开发的一大障碍。由于CD8 T细胞免疫激活而产生的毒性大致有两种:细胞因子释放综合征(CRS)和免疫效应细胞相关神经毒性综合征(ICANS)。
CRS是一种潜在致命的全身性炎症过激反应,其特征是过度的细胞因子分泌和相关的生理变化。细胞因子最初由活化的T细胞分泌,以干扰素-γ(IFN-γ)为主,随后招募的其他免疫细胞(如巨噬细胞和单核细胞)会释放其它的介导因子,如促炎细胞因子IL-6、TNF、IL-2、IL-2受体和IL-8等。CRS轻微的症状包括发烧、肌痛和/或头痛,严重的则出现低血压,毛细血管渗漏,最终循环衰竭。 尽管已探索出缓解 CRS 的策略,例如CD20 单抗obinutuzumab预给药、起始剂量递增或糖皮质激素预给药,但在已发表的临床试验中,CRS 仍然是 Glofitamab 治疗中最常见的不良反应。
ICANS的机制尚不清晰,经常伴随着CRS或在CRS之后发生,估计与细胞因子效应对中枢神经系统的影响有关。
其他被报道的常见 3 级毒性主要是血液学(中性粒细胞减少、血小板减少和贫血),但也包括 γ-戊二酰转移酶升高和感染并发症(肺炎、发热性中性粒细胞减少)。
5. 反应标志物和耐药机制
Glofitamab 的疗效不依赖于肿瘤 T 细胞浸润的基线水平或肿瘤 CD20 表达程度。相反,增殖、免疫排斥和免疫逃逸相关的标志物在无应答者的肿瘤细胞中有更高水平表达。另外,在应答者中发现有更多的 CD8 T效应细胞富集和较低的PD-1 表达,暗示应答者T 细胞的基线耗竭程度。反应标志物研究表明肿瘤和患者本身免疫状态都与疗效相关,体现了肿瘤和 T 细胞宿主因子之间的复杂相互作用 [6]。
6. 未来市场预测
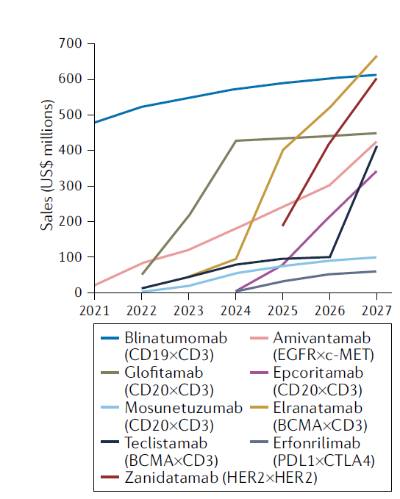
图3. 部分双特异性抗体未来销售额预测
全球双特异性抗体治疗肿瘤市场有望迅速扩张,销售预计将到2027年将接近37亿美元(图3)。靶向CD20×CD3的治疗B细胞非霍奇金淋巴瘤(NHL)的药物销售额预估在2027年占双特异性抗体市场份额的近25%。Glofitamab预计将是三个CD20×CD3 双特异性抗体中未来最畅销(4.5亿美元)的,其次是epcoritamab(3.45亿美元)。这两种抗体的销售估值依据是DLBCL适应症获批。
7. 结论
Glofitamab是一种新型双特异性抗体TCE对B细胞淋巴瘤有显著而持久的疗效。主要毒性包括CRS和ICANS,可通过CD20单抗obinutuzumab预给药和起始剂量递增的方法进行控制,很少导致停药。与CAR — T相比,CRS和神经毒性的发生率显著降低。未来商业前景巨大。
鉴于T 细胞耗竭状态与 Glofitamab 耐药的相关性,通过激活共刺激靶点如4-1BB[7],来促进 T 细胞增殖和活化,将有望提高疗效。根据这一思路, Glofitamab 与靶向 B 细胞标志物CD19 的共刺激分子 4-1BB 配体双特异性抗体RO7227166联用的治疗方案正处于临床一期(NCT04077723)。
礼进生物自研的新一代TCE设计思路则是在肿瘤抗原依赖性前提下,在CD3基础上添加4-1BB共刺激靶点,根据4-1BB可以更有针对性地激活CD8 T细胞细胞毒性(cytotoxicity)的特点,礼进生物的新一代TCE激动剂多抗xLinkMsAb有望突破性地提升TCE的有效性和安全性。另外,xLinkMsAb采用的是类似IgG的分子结构,为高成药性提供了前提条件。目前公司正在积极寻求技术转让和合作开发机会。
参考文献:
1. Minson, A. and M. Dickinson, Glofitamab CD20-TCB bispecific antibody. Leukemia & Lymphoma, 2021. 62(13): p. 3098-3108.
2. Surowka, M., W. Schaefer, and C. Klein, Ten years in the making: application of CrossMab technology for the development of therapeutic bispecific antibodies and antibody fusion proteins. mAbs, 2021. 13(1): p. 1967714.
3. Inc, H.L.R., US9914776B2 Bispecific T cell activating antigen binding molecules.
4. Esfandiari, A., S. Cassidy, and R.M. Webster, Bispecific antibodies in oncology. Nat Rev Drug Discov, 2022. 21(6): p. 411-412.
5. Martin Hutchings, C.C.-S., Emmanuel Bach, Fritz Offner, Franck Morschhauser, Michael Crump, Gloria Iacoboni, Anna Sureda Balari, Joaquin Martinez-Lopez, Linda Lundberg, Mark Dixon, David Perez Callejo, James Relf, David Carlile, Emily Piccione, Kathryn Humphrey, Michael Dickinson,, 403 Glofitamab Step-up Dosing Induces High Response Rates in Patients with Hard-to-Treat Refractory or Relapsed Non-Hodgkin Lymphoma. ASH 2020, 2020.
6. Bröske, A.-M.E., et al., Pharmacodynamics and molecular correlates of response to glofitamab in relapsed/refractory non-Hodgkin lymphoma. Blood Advances, 2022. 6(3): p. 1025-1037.
7. Sanchez-Paulete, A.R., et al., Deciphering CD137 (4-1BB) signaling in T-cell costimulation for translation into successful cancer immunotherapy. European Journal of Immunology, 2016. 46(3): p. 513-522.
免责声明:本文目的仅限于分享知识,内容不代表礼进生物科技有限公司观点。






 沪公网安备 31011502015333号
沪公网安备 31011502015333号