

学习资源
科普文章
软组织肉瘤的免疫状态:为免疫治疗提供线索
软组织肉瘤是一种罕见的异质性肿瘤,其复杂性导致临床诊断和治疗极具挑战性。以一篇综述为基础,我们会系统介绍免疫细胞、可溶性血浆因子、免疫检查点的生物学功能,它们潜在的软组织肉瘤治疗应答的预测作用,以及带给软组织肉瘤免疫治疗新药物开发的启示。
系列四:免疫检查点抑制剂 (ICI) 联合抗血管生成治疗晚期肉瘤
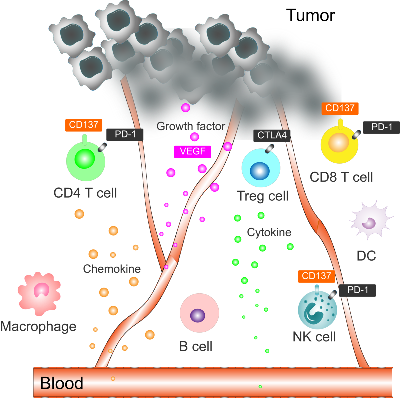
免疫检查点抑制剂(Immune checkpoint inhibitors,ICI),主要包括抗 PD-1/PD-L1 和抗 CTLA4 抗体,是治疗包括肉瘤在内的各种晚期癌症的手段之一。既往研究表明,肉瘤患者中 PD-1/PD-L1 的表达与 T 细胞浸润和 B 细胞活化呈强正相关(Kim, Kim et al. 2021)(Petitprez, de Reyniès et al. 2020)。在 SARC028 和 Alliance A0914401 临床试验中,抗 PD-1 药物(pembrolizumab 和 nivolumab)或联合抗 CTLA 药物(ipilimumab)在晚期/转移性肉瘤中显示出临床受益,但总体缓解率 (Overall Response Rate,ORR)较低,分别只有 18% 和 16% (D'Angelo, Mahoney et al. 2018)(Tawbi, Burgess et al. 2017)。大多数无反应者与免疫细胞(如 T 细胞和巨噬细胞)浸润不足,以及与PD-L1 表达水平低呈显著相关性。由于免疫系统功能性失调,而产生的肿瘤微环境 (TME) 免疫抑制性,会影响治疗效果(Rabinovich, Gabrilovich et al. 2007)。而血管生成已被证明在肾细胞癌和黑色素瘤中会维持肿瘤微环境的免疫抑制性,降低抗肿瘤活性(Yang, Yan et al. 2018)(You, Guo et al. 2021)。
血管内皮生长因子 (Vascular endothelial growth factor ,VEGF) 被认为是血管生成的主要驱动基因,导致肿瘤生长和转移,并抑制免疫治疗反应(Fukumura, Kloepper et al. 2018)。 因此,包括安罗替尼、帕唑帕尼和瑞戈非尼在内的抗 VEGF 受体酪氨酸激酶抑制剂 (TKI) 对软组织肉瘤具有抗癌活性(Berry, Basson et al. 2017)(Chi, Fang et al. 2018)(Weiss, Chen et al. 2020)。 值得注意的是,基于 VEGF 在肿瘤微环境抑制性中的作用,免疫检查点抑制剂的疗法与 TKI 相结合已在各种类型的癌症中显示出良好的结果(Fukumura, Kloepper et al. 2018)。
在一项在 33 名晚期肉瘤患者中联合使用口服 TKI阿西替尼(axitinib)与派姆单抗(pembrolizumab)的II期单臂研究中(Wilky, Trucco et al. 2019),客观缓解率(Objective Response Rate,ORR) 为 25%,疾病控制率 (Disease Control Rate,DCR)为 53.1%。中位无进展生存期(Progression-Free Survival, PFS)为 4.7 个月,中位总生存期 (Overall Survival, OS) 为 18.7 个月。其中11 名肺泡软组织肉瘤 (alveolar soft part sarcoma ,ASPS)患者的客观缓解率ORR为54.5%,高于阿昔替尼或派姆单抗单独用药的预期(Eulo and Van Tine 2022)。
最近一项在 68 名晚期软组织患者中评估纳武利尤单抗(nivolumab)与舒尼替尼(sunitinib)的组合治疗肉瘤的 Ib/II 期试验中(Martin-Broto, Hindi et al. 2020), 6 个月PFS为 48% ,中位PFS为 5.6 个月,中位OS为 24 个月,18 个月生存率为 67%。 ORR为 21%,有应答的患者在 18 个月时存活率为100% 。ORR、PFS和 OS都优于抗 PD-1抗体或舒尼替尼单药治疗的历史数据(Tawbi, Burgess et al. 2017) (George, Merriam et al. 2009)。
在一项收集了 61 名接受免疫检查点抑制剂(ICI)或ICI联合 TKI 治疗的软组织肉瘤患者数据的回顾性研究中,患者亚群包括平滑肌肉瘤 (Leiomyosarcoma, LMS)、去分化脂肪肉瘤 (Dedifferentiated Liposarcom, DDLPS)、未分化多形性肉瘤 (Undifferentiated Pleomorphic Sarcoma, UPS)、粘液纤维肉瘤 (Myxofibrosarcoma, MFS) 和血管肉瘤 (Angiosarcoma, AS) (You, Guo et al. 2021)。与单独使用ICI治疗(6.81 个月)相比,ICI联合 TKI 治疗后的中位PFS显着延长(11.74 个月)。接受联合治疗的患者的 12 个月PFS%从 20.26% 增加到 42.90 %。在联合治疗组中的3个月或更长时间的随访中,12 名患者(30%)达到部分缓解(Partial Response,PR),25 名患者(62.5%)达到疾病稳定 (Stable Disease, SD),3 名患者(7.5%)达到 疾病进展(Progressive Disease, PD)。在ICI单独治疗组中, 3个月内PR 2例(9.5%),SD 14例(66.7%),PD 5例(23.8%)。两组ORR分别为30.0%(ICI-TKI联合)和9.5%(ICI单独)。 ICI-TKI 联合治疗组的某些亚型中观察到较高的ORR,尤其是肺泡软组织肉瘤ASPS(66.7%)、粘液纤维肉瘤MFS(42.9%)和 未分化多形性肉瘤UPS(33.3%)亚型。这项研究证明了 ICI-TKI 联合治疗软组织肉瘤的抗肿瘤活性,特别是在肺泡软组织肉瘤ASPS 和粘液纤维肉瘤 MFS 亚型,并提示了研究有效生物标志物来预测临床结果的意义。
在一项免疫调节机制研究中,研究人员在肉瘤的体外共培养实验体系中评估了 TKI 舒尼替尼 和/或抗PD-1抗体纳武利尤单抗的治疗作用。 数据表明,用 TKI 舒尼替尼处理肉瘤细胞可以对免疫细胞亚群产生显着的免疫激活效果:通过树突状细胞(Dendritic Cell, DC) 的介导,诱导了生成IFN-γ的效应 T 细胞的增加,抑制性T细胞Treg的减少。 另外,抗PD-1纳武利尤单抗与舒尼替尼的联合治疗被证明有协同作用,为TKI 和抗 PD-1 联合治疗肉瘤提供了理论依据(Ocadlikova, Lecciso et al. 2021)。
CD137 (又称为TNFRSF9, 4-1BB) 提供共刺激信号并激活 CD8(+) T 细胞的细胞毒性作用并帮助形成记忆 T 细胞。此外,CD137 信号可以激活 NK 细胞和树突状细胞,进一步支持细胞毒性 T 细胞的激活。 CD137 的激动性单克隆抗体 urelumab 提供了有希望的临床疗效信号,但遗憾的是其临床应答剂量高于最大耐受剂量。 Utomilumab 是另一种针对 CD137 的 CD137 单克隆抗体,但不如 urelumab 有效。抗体工程技术的最新进展已经能够减轻阻碍 Urelumab 临床应用的肝毒性,并能够保持与 Urelumab 相似的效力。目前在临床试验中的下一代 CD137 激动剂抗体支持患者样本中的 T 细胞和 NK 细胞扩增(Hashimoto 2021)。 CD137 激动剂与 TKI 或其它标准治疗方案的组合治疗有可能有助于提高肿瘤免疫治疗的安全性和有效性。其协同作用机制,尤其是CD137 激动剂对于优化和维持软组织肉瘤中的 T 细胞活化状态的效果,需要进一步临床研究来验证。
肿瘤药物终点的定义*
肿瘤缓解的评估(根据实体瘤疗效评估RECIST1.1靶病灶缓解标准)
完全缓解(Complete Response,CR):所有靶病灶消失,全部病理淋巴结(包括靶结节和非靶结节)短直径必须减少至<10mm。
部分缓解(Partial Response,PR):靶病灶直径之和比基线水平减少至少30%。
疾病进展(Progressive Disease, PD):以整个实验研究过程中所有测量的靶病灶直径之和的最小值为参照,直径和相对增加至少20%(如果基线测量值最小就以基线值为参照);除此之外,必须满足直径和的绝对值增加至少5mm(出现一个或多个新病灶也视为疾病进展)。
疾病稳定(SD):靶病灶减小的程度没达到PR,增加的程度也没达到PD水平,介于两者之间,研究时可以直径之和的最小值作为参考。
疾病进展时间(Time To Progression,TTP)和无进展生存期(Progression-Free Survival,PFS)疾病进展时间(TTP)定义为从随机分组开始至出现肿瘤客观进展之间的时间;TTP不包括死亡。无进展生存期(PFS)定义为从随机分组开始至出现肿瘤客观进展或死亡之间的时间。
总生存期(Overall Survival,OS)总生存期定义为从随机化开始到因各种原因导致病人死亡之间的时间,且是按意向治疗人群(ITT)计算。
无病生存期(Disease-Free Survival,DFS)无病生存期(DFS)通常定义为患者从随机分组开始到出现肿瘤复发或由任何原因引起死亡之间的时间。
客观缓解率(Objective Response Rate,ORR)客观缓解率(ORR)是指肿瘤体积缩小达到预先规定值并能维持最低时限要求的患者比例。缓解期通常是指从开始出现疗效直至证实出现肿瘤进展的这段时间。一般定义客观缓解率为完全缓解加上部分缓解之和。
疾病控制率 (Disease Control Rate,DCR) /临床受益率(Clinical Benefit Rate,CBR)在抗癌药物临床试验中对治疗干预达到完全缓解CR、部分缓解PR和疾病稳定SD的晚期或转移性癌症患者的百分比。
*部分定义来源于FDA/CDE发布的《抗肿瘤药物临床试验终点的技术指导原则》。
参考文献:
1.Aykan, N. F. and T. Ozatli (2020). "Objective response rate assessment in oncology: Current situation and future expectations." World J Clin Oncol 11(2): 53-73.
2.Berry, V., L. Basson, E. Bogart, O. Mir, J. Y. Blay, A. Italiano, F. Bertucci, C. Chevreau, S. Clisant-Delaine, B. Liegl-Antzager, E. Tresch-Bruneel, J. Wallet, S. Taieb, E. Decoupigny, A. Le Cesne, T. Brodowicz and N. Penel (2017). "REGOSARC: Regorafenib versus placebo in doxorubicin-refractory soft-tissue sarcoma-A quality-adjusted time without symptoms of progression or toxicity analysis." Cancer 123(12): 2294-2302.
3.Borcoman, E., A. Nandikolla, G. Long, S. Goel and C. Le Tourneau (2018). "Patterns of Response and Progression to Immunotherapy." Am Soc Clin Oncol Educ Book 38: 169-178.
4.Chi, Y., Z. Fang, X. Hong, Y. Yao, P. Sun, G. Wang, F. Du, Y. Sun, Q. Wu, G. Qu, S. Wang, J. Song, J. Yu, Y. Lu, X. Zhu, X. Niu, Z. He, J. Wang, H. Yu and J. Cai (2018). "Safety and Efficacy of Anlotinib, a Multikinase Angiogenesis Inhibitor, in Patients with Refractory Metastatic Soft-Tissue Sarcoma." Clin Cancer Res 24(21): 5233-5238.
5.Choi, J. H., M. J. Ahn, H. C. Rhim, J. W. Kim, G. H. Lee, Y. Y. Lee and I. S. Kim (2005). "Comparison of WHO and RECIST criteria for response in metastatic colorectal carcinoma." Cancer Res Treat 37(5): 290-293.
6.D'Angelo, S. P., M. R. Mahoney, B. A. Van Tine, J. Atkins, M. M. Milhem, B. N. Jahagirdar, C. R. Antonescu, E. Horvath, W. D. Tap, G. K. Schwartz and H. Streicher (2018). "Nivolumab with or without ipilimumab treatment for metastatic sarcoma (Alliance A091401): two open-label, non-comparative, randomised, phase 2 trials." Lancet Oncol 19(3): 416-426.
7.Eulo, V. and B. A. Van Tine (2022). "Immune checkpoint inhibitor resistance in soft tissue sarcoma." Cancer Drug Resist 5(2): 328-338.
8.Fukumura, D., J. Kloepper, Z. Amoozgar, D. G. Duda and R. K. Jain (2018). "Enhancing cancer immunotherapy using antiangiogenics: opportunities and challenges." Nat Rev Clin Oncol 15(5): 325-340.
9.George, S., P. Merriam, R. G. Maki, A. D. Van den Abbeele, J. T. Yap, T. Akhurst, D. C. Harmon, G. Bhuchar, M. M. O'Mara, D. R. D'Adamo, J. Morgan, G. K. Schwartz, A. J. Wagner, J. E. Butrynski, G. D. Demetri and M. L. Keohan (2009). "Multicenter phase II trial of sunitinib in the treatment of nongastrointestinal stromal tumor sarcomas." J Clin Oncol 27(19): 3154-3160.
10.Hashimoto, K. (2021). "CD137 as an Attractive T Cell Co-Stimulatory Target in the TNFRSF for Immuno-Oncology Drug Development." Cancers (Basel) 13(10).
11.Kim, S. K., J. H. Kim, S. H. Kim, Y. H. Lee, J. W. Han, W. Baek, H. Y. Woo, M. K. Jeon and H. S. Kim (2021). "PD-L1 tumour expression is predictive of pazopanib response in soft tissue sarcoma." BMC Cancer 21(1): 336.
12.Martin-Broto, J., N. Hindi, G. Grignani, J. Martinez-Trufero, A. Redondo, C. Valverde, S. Stacchiotti, A. Lopez-Pousa, L. D'Ambrosio, A. Gutierrez, H. Perez-Vega, V. Encinas-Tobajas, E. de Alava, P. Collini, M. Pe?a-Chilet, J. Dopazo, I. Carrasco-Garcia, M. Lopez-Alvarez, D. S. Moura and J. A. Lopez-Martin (2020). "Nivolumab and sunitinib combination in advanced soft tissue sarcomas: a multicenter, single-arm, phase Ib/II trial." J Immunother Cancer 8(2).
13.Ocadlikova, D., M. Lecciso, J. M. Broto, K. Scotlandi, M. Cavo, A. Curti and E. Palmerini (2021). "Sunitinib Exerts In Vitro Immunomodulatory Activity on Sarcomas via Dendritic Cells and Synergizes With PD-1 Blockade." Front Immunol 12: 577766.
14.Petitprez, F., A. de Reyniès, E. Z. Keung, T. W. Chen, C. M. Sun, J. Calderaro, Y. M. Jeng, L. P. Hsiao, L. Lacroix, A. Bougoüin, M. Moreira, G. Lacroix, I. Natario, J. Adam, C. Lucchesi, Y. H. Laizet, M. Toulmonde, M. A. Burgess, V. Bolejack, D. Reinke, K. M. Wani, W. L. Wang, A. J. Lazar, C. L. Roland, J. A. Wargo, A. Italiano, C. Sautès-Fridman, H. A. Tawbi and W. H. Fridman (2020). "B cells are associated with survival and immunotherapy response in sarcoma." Nature 577(7791): 556-560.
15.Rabinovich, G. A., D. Gabrilovich and E. M. Sotomayor (2007). "Immunosuppressive strategies that are mediated by tumor cells." Annu Rev Immunol 25: 267-296.
16.Tawbi, H. A., M. Burgess, V. Bolejack, B. A. Van Tine, S. M. Schuetze, J. Hu, S. D'Angelo, S. Attia, R. F. Riedel, D. A. Priebat, S. Movva, L. E. Davis, S. H. Okuno, D. R. Reed, J. Crowley, L. H. Butterfield, R. Salazar, J. Rodriguez-Canales, A. J. Lazar, Wistuba, II, L. H. Baker, R. G. Maki, D. Reinke and S. Patel (2017). "Pembrolizumab in advanced soft-tissue sarcoma and bone sarcoma (SARC028): a multicentre, two-cohort, single-arm, open-label, phase 2 trial." Lancet Oncol 18(11): 1493-1501.
17.Weiss, A. R., Y. L. Chen, T. J. Scharschmidt, Y. Y. Chi, J. Tian, J. O. Black, J. L. Davis, J. C. Fanburg-Smith, E. Zambrano, J. Anderson, R. Arens, O. Binitie, E. Choy, J. W. Davis, A. Hayes-Jordan, S. C. Kao, M. L. Kayton, S. Kessel, R. Lim, W. H. Meyer, L. Million, S. H. Okuno, A. Ostrenga, M. T. Parisi, D. A. Pryma, R. L. Randall, M. A. Rosen, M. Schlapkohl, B. L. Shulkin, E. A. Smith, J. I. Sorger, S. Terezakis, D. S. Hawkins, S. L. Spunt and D. Wang (2020). "Pathological response in children and adults with large unresected intermediate-grade or high-grade soft tissue sarcoma receiving preoperative chemoradiotherapy with or without pazopanib (ARST1321): a multicentre, randomised, open-label, phase 2 trial." Lancet Oncol 21(8): 1110-1122.
18.Wilky, B. A., M. M. Trucco, T. K. Subhawong, V. Florou, W. Park, D. Kwon, E. D. Wieder, D. Kolonias, A. E. Rosenberg, D. A. Kerr, E. Sfakianaki, M. Foley, J. R. Merchan, K. V. Komanduri and J. C. Trent (2019). "Axitinib plus pembrolizumab in patients with advanced sarcomas including alveolar soft-part sarcoma: a single-centre, single-arm, phase 2 trial." Lancet Oncol 20(6): 837-848.
19.Yang, J., J. Yan and B. Liu (2018). "Targeting VEGF/VEGFR to Modulate Antitumor Immunity." Front Immunol 9: 978.
20.You, Y., X. Guo, R. Zhuang, C. Zhang, Z. Wang, F. Shen, Y. Wang, W. Liu, Y. Zhang, W. Lu, Y. Hou, J. Wang, X. Zhang, M. Lu and Y. Zhou (2021). "Activity of PD-1 Inhibitor Combined With Anti-Angiogenic Therapy in Advanced Sarcoma: A Single-Center Retrospective Analysis." Frontiers in Molecular Biosciences 8.
免责声明:本文仅作信息分享,不代表礼进生物公司立场和观点,也不作治疗方案推荐和介绍。如有需求,请咨询和联系正规医疗机构。
礼进生物(Lyvgen Biopharma)的网站(中文)
礼进生物创建于2016年,以其全球创新的肿瘤免疫激动性抗体管线为核心,凭借其世界级的研发团队,最前沿的药物研发项目,以及开放式创新的策略, 有望引领国内新药研发行业走向全球。
https://user-assets.sxlcdn.com/images/676507/FiTA8WK-FQRyXrQDyd-HDkY3tpfI.png?imageMogr2/strip/auto-orient/thumbnail/1200x630>/format/png


 沪公网安备 31011502015333号
沪公网安备 31011502015333号