

科普文章
关于CD8+ 耗竭 T ( Tex ) 细胞“油门”靶点CD137(4-1BB)的最新研究表明:随后的CD137(4-1BB)刺激可提高PD-1抗体功效
•T 细胞特异性删除 CD137 限制了肿瘤中CD8+ Tex细胞的存在
•NF- κB依赖性 CD137 信号传导刺激Tex细胞增殖和分化
•CD137 激活驱动Tex细胞基因的Tox依赖性表观遗传重塑
•随后的 CD137 刺激可提高抗 PD1 功效
概述
CD137 (4-1BB) 激活受体是一种有前景的癌症免疫治疗靶点。然而,CD137 驱动的细胞程序及其在癌症免疫监视中的作用尚不清晰。使用 T 细胞特异性缺失和激动抗体,作者发现 CD137 调节表达 PD1、Lag-3 和 Tim-3 抑制性受体的 CD8+ 耗竭 T ( Tex ) 细胞的肿瘤浸润。 T 细胞固有的、不依赖于 TCR 的 CD137 信号传导通过涉及RelA和cRel典型 NF- κB亚基和Tox依赖性染色质重塑的机制刺激Tex前体细胞的增殖和终末分化。虽然预防性 CD137 激动剂诱导的Tex细胞积聚有利于肿瘤生长,但在临床前小鼠模型中随后的 CD137 刺激可提高抗 PD1 功效。更好地了解 T 细胞耗竭对于癌症和传染病的治疗具有重要意义。作者的结果表明 CD137 是Tex细胞扩增和分化的关键调节因子,具有广泛的治疗应用潜力。 [1]
介绍
共抑制受体,例如 PD1、Tim3、Lag-3、TIGIT 和 CTLA-4 在驱动 CD8+ T 细胞低反应状态(称为 T 细胞耗竭)方面发挥着关键作用,这种状态在慢性病毒感染和癌症中经常观察到。尽管耗竭的 T ( Tex ) 细胞代表了一种独特的 T 细胞谱系,但“T 细胞耗竭”是一个通用术语,包括与效应 T 细胞功能障碍相关的各种不同的表观遗传和代谢状态。调节Tex细胞程序的转录因子 (TF),包括Eomes 、TCF-1和高迁移率组 (HMG) 蛋白 Tox. 由于持续抗原暴露而延长的 T 细胞受体 (TCR) 信号传导似乎是慢性感染和癌症T 细胞中耗竭的主要原因。然而,作者对于可能参与影响Tex细胞分化的其他信号以及相应机制仍知之甚少。
针对T细胞耗竭来治疗癌症的策略已通过 PD1 和 CTLA-4阻断抗体的临床成功得以证明。 尽管如此,这些免疫检查点阻断剂 (ICB) 可能只能对于Tex细胞中具有祖细胞或干细胞特征的子集有效果,并且确实仅在一小部分癌症患者中观察到临床反应。因此,正在积极寻找提高 ICB 疗效的替代方案。当前大多数策略是探索其它抑制性受体,但实际上激活性受体也可能影响癌症免疫疗法的疗效。
CD137 (TNFRSF9, 4-1BB) 是肿瘤坏死因子受体 (TNFR) 超家族的共刺激成员,由活化的 T 细胞和其他细胞表达。表达在活化的树突状细胞 (DC)上的其天然配体 CD137L (4-1BBL, TNFSF9)可诱导 CD137 激活,从而增强 T 细胞增殖和细胞因子分泌,并保护 T 细胞免遭活化诱导的细胞死亡。CD137 刺激可扩大 CD8+ 效应记忆 T (Tem) 细胞,并促进不同小鼠模型中的肿瘤消退。因此,CD137 代表了一种有前景的癌症免疫治疗靶点。然而,抗 CD137单克隆抗体(例如urelumab)的功效有限,并且在早期临床试验中显示出肝毒性。此外,抗 CD137 激动剂的抗肿瘤与免疫调节活性的机制在很大程度上尚不清楚。事实上,抗 CD137 激动剂可减轻几种自身免疫小鼠模型的临床症状,表明 CD137 刺激可能会抑制免疫反应。因此,CD137 受体激活所驱动的细胞程序变化值得深入研究,以便更好地理解 CD137 信号传导的功能后果。在本项研究中,通过转录组、表观基因组和功能分析,作者证明了 T 细胞特异性 CD137 信号传导在 CD8+ T 细胞耗竭程序中的重要性。使用 T 细胞特异性 CD137 缺陷小鼠,作者发现 CD137 缺失限制了不同小鼠肿瘤模型中肿瘤相关的Tex细胞。 CD137 由 CD8+ Tex细胞特异性表达,CD137 激动剂促进这些细胞的TCR非依赖性、NF- κB依赖性增殖和终末分化。最后,虽然预防性抗 CD137 治疗诱导的Tex细胞积累有利于肿瘤逃逸,但作者发现随后的 CD137 刺激可提高 PD1 功效。
作者研究表明内源性地T细胞CD137信号通路激活是Tex细胞扩增和分化的重要组成部分,因此提出了关于 TCR 信号传导在此机制中的作用的问题。慢性 TCR 刺激即使不是唯一已知的,也是 CD8+ T 细胞耗竭的主要驱动因素。然而,使用 Nur77GFP TCR 报告基因、TCR 转基因 MHC-I 缺陷小鼠或钙调神经磷酸酶抑制剂进行的实验均表明CD137对于Tex细胞的促进作用是不依赖于 TCR / 钙调神经磷酸酶的。相反,研究结果揭示了RelA和cRel亚基在CD137 的Tex细胞诱导作用中的重要性,表明经典 NF- κB途径的激活可能有利于 CD8+ Tex细胞程序。该研究结果提出了一个问题:与 CD137 共享信号通路的其他 TNFR 成员是否也可能促进 T 细胞耗竭程序。然而,在后续的实验中,OX-40 和 GITR 激动剂都没有诱导衰竭相关标记,尽管这两种受体都像 CD137 一样促进 TRAF2 依赖性 NF- κB信号传导和存活。刺激Tex细胞扩增的CD137 信号传导有待后续研究继续完善。
但是,该研究结果并不排除 TCR 信号传导在 T 细胞耗竭中的作用。事实上,作者发现 CD137 刺激不会影响幼稚或 PD1− 记忆 CD8+ T 细胞,而是会扩展并促进已经呈现Tex样程序的细胞的终末分化。事实上,在人和小鼠的肿瘤和慢性感染组织中,流式细胞术和scRNA-seq分析都支持CD8+ T 细胞中的Tex细胞特异性表达 CD137。值得注意的是,对公共数据集的分析表明,Tnfrsf9表达仅限于慢性 LCMV 或肿瘤时产生的Tex细胞群,而不是急性 LCMV 感染中发现的真正效应记忆 CD8+ T 细胞。虽然慢性 TCR 信号传导可能是Tex细胞表达 CD137 的原因,但已确定了几种独立于TCR之外的机制,包括 IL-15 或 IL-2 以及 GITR都可诱导的非TCR依赖性的CD137表达。缺氧驱动的 Hif1α 也在肿瘤环境中诱导 CD137 表达。 TCR - CD137 的独立表达被认为有助于在缺乏特定抗原的情况下维持 CD8 Tmem细胞池。 作者的结果表明了类似的机制,即 CD8+ Tex细胞上的高 CD137 表达可能有助于其维持和扩增,即使在缺乏活跃的 TCR 信号传导的情况下。
很多科研团队,包括本研究作者所在实验室,均在不同动物肿瘤模型上证明了CD137激动剂抗体的抗肿瘤功能。尽管有充分的临床前研究证据,CD137激动剂抗体的临床疗效仍然有限。另外,临床试验还揭示了抗 CD137 mAb urelumab 的严重不良事件 (SAE)。抗 CD137 mAb诱导的效应功能有限的Tex细胞的系统性扩张可能是迄今为止令人失望临床表现的原因。事实上,作者发现用抗 CD137 mAb对小鼠进行预防性治疗随后增加了不同免疫原性肿瘤模型的生长,并限制了抗 PD1 免疫疗法的功效。与这些结果一致,抗 CD137 激动剂已被证明可以限制几种小鼠模型中的自身免疫性疾病。Tex细胞的全身扩张也可能是癌症患者中抗 CD137 诱导的 SAE 的原因。 事实上,老年患者有很长的感染史,可能含有更多的 CD8+ Tex细胞,这些细胞可能会扩增,并可能在全身 CD137 刺激后引起肝脏炎症。 这些结果强调了肿瘤内递送抗 CD137 mAb以限制旁观者Tex亚群全身激活风险的策略的重要性,尽管 TIL 的长期益处仍然是假设的。
T 细胞耗竭程序通常被认为是一种肿瘤逃逸机制,限制了 CD8+ T 细胞的抗肿瘤功能。事实上, Tex细胞的效应器功能降低,并表现出高水平的抑制性受体。然而, Tex细胞并不是惰性的,T 细胞耗竭在癌症和慢性传染病中可能并不总是不利的。事实上, Tex细胞具有残余功能,这在体内对于控制肿瘤生长和病毒复制可能很重要。例如,在猿猴免疫缺陷病毒 (SIV) 感染的慢性阶段, CD8+ Tex细胞的消耗导致病毒血症加剧。 在本研究中,作者发现与 WT 同行相比,CD137 缺陷小鼠中Tex细胞频率的降低减少了 CD8+ T 细胞浸润并增加了肿瘤生长。在缺乏 Tox 的情况下,慢性传染病中效应 T 细胞持久性也出现了类似的下降。因此, Tex细胞程序似乎可以确保慢性病原体或肿瘤控制,同时限制T细胞过分激活可能介导的免疫过激不良反应。维持和调控Tex细胞子集是最有前途的抗肿瘤策略之一。然而,预先存在的肿瘤特异性 T 细胞的重生能力可能有限,并且对抑制性检查点抗体有应答 T 细胞实际上可能源自最近进入肿瘤的 T 细胞的某个特定的克隆亚群。 在这种情况下,正如本研究中肿瘤小鼠模型所验证的,抗 CD137 激动剂对于Tex细胞的非TCR依赖性的扩增作用,可能有重要的临床应用价值,有望提高免疫检查点阻断剂 (ICB)功效。
研究结果
Tex细胞的肿瘤浸润
为了解决 CD137 在 CD8+ T 细胞抗肿瘤监视中的作用,作者将 Cd137fl/ fl小鼠与 Cd4cre 小鼠杂交,特别删除 T 细胞区室中的 CD137 表达。 Cd4CreCd137fl/ fl和 Cd137fl/ fl分别称为 Cd137−/− 和 Cd137+/+ 小鼠,皮下注射MC38结肠癌细胞或 B16K1 黑色素瘤细胞(图 1A),这是两种 CD8+ T 细胞依赖性免疫原性肿瘤模型。 24 ,25,26 CD137 缺陷导致 B16K1 和 MC38 小鼠模型中后期的肿瘤负荷更高,表明 CD137 的缺失会对 T 细胞抗肿瘤免疫反应产生负面影响(图 1A)。事实上,CD137 缺陷降低了这些肿瘤模型中 CD8+ 肿瘤浸润 T 淋巴细胞 (TIL) 的频率和数量(图 1B )。与 Cd137+/+ 小鼠相比,Cd137−/− 小鼠中表达 PD1 和 Tim3 的 CD8+ TIL 减少,也观察到 B16K1 或 MC38-CD8+ TIL 表型差异(图 1C)。
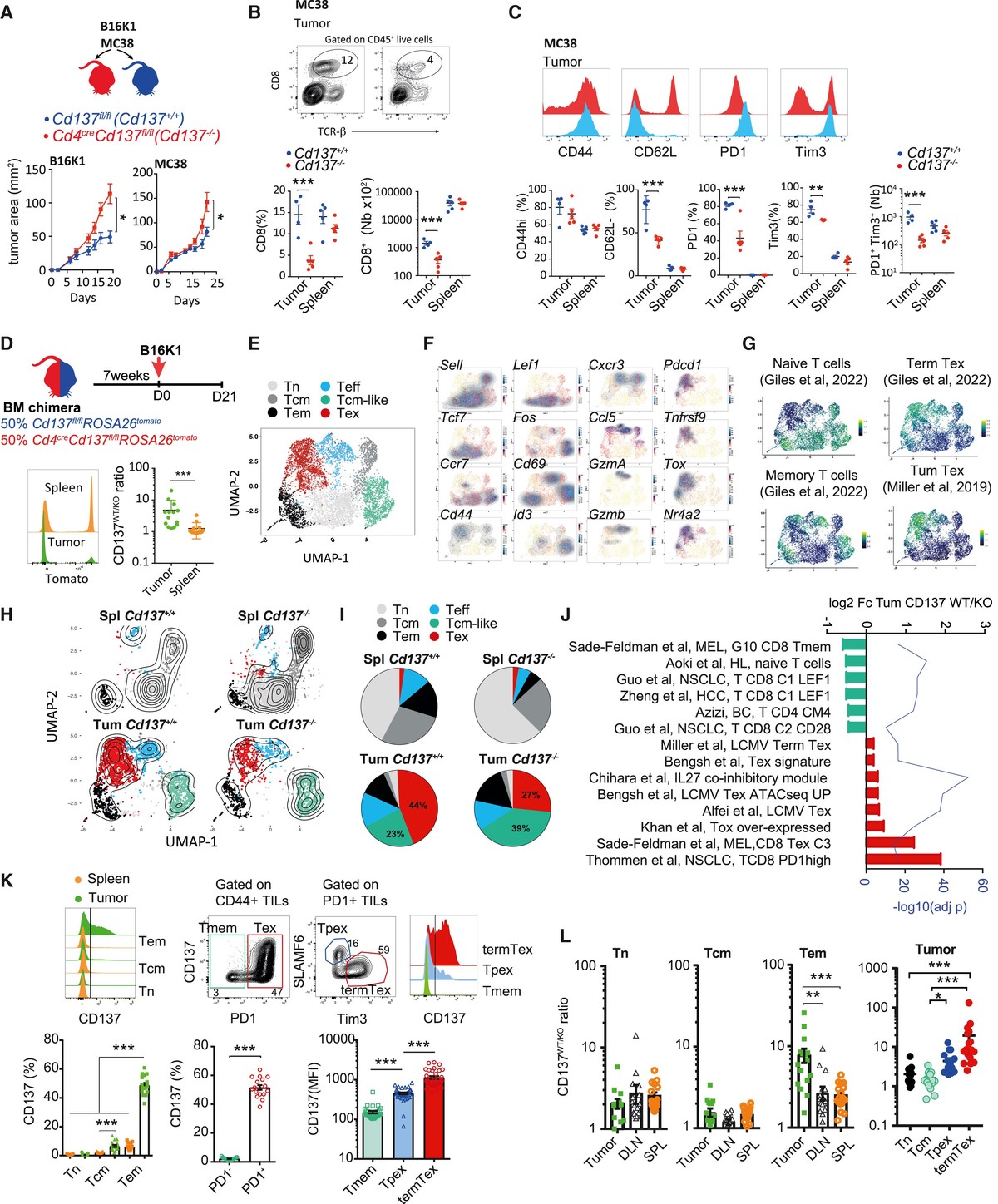
图1:CD137缺乏限制肿瘤浸润的Tex细胞
(A–C) 皮下注射 Cd4cre Cd137fl/ fl ( Cd137−/−) 和 Cd137fl/ fl (Cd137+/+) 。与 MC38 或 B16K1 细胞。 (A) 肿瘤区域。 (B) CD8+ T 细胞的频率和数量。 (C) CD8+ T 细胞表达所示标记物。
(D–J) 皮下注射 Cd4creCd137fl/flROSA26tomato 和 Cd137fl/flROSA26tomato 混合 BM 嵌合体。与 B16K1 细胞。 21 天后,通过单细胞 RNA 测序 ( scRNA-seq ) 分析 Cd137−/−(番茄+)和 Cd137+/+(番茄−)脾脏和肿瘤浸润 CD8+ T 细胞。 (n = 7 只合并小鼠/组。) (D) CD137+/+ 与 CD137−/− (CD137WT/KO) 脾脏和肿瘤浸润 CD8+ T 细胞的比率。 (E) 脾脏和肿瘤浸润 CD8+ T 细胞的转录组景观分散在 6 个簇中。 (F 和 G) 所示基因 (F) 和特征 (G) 的相对表达。
(H 和 I) UMAP (H) 和图表 (I) 显示指定样本中的簇频率。
(J) 富集 Cd137+/+ 与 Cd137−/− 肿瘤浸润 CD8+ T 细胞的相关途径的表达倍数变化和调整后的 p 值。
(K) 19 天后所示脾脏或 B16K1 肿瘤浸润 CD8+ T 细胞亚群的 CD137 表达。
(L) 来自带有混合 BM 嵌合体的 B16K1 的所示 CD8+ T 细胞亚群中的 CD137WT/KO 比率,如 (D) 中所示。数据以至少 2 个独立实验的平均值±SEM 表示。每个符号代表一只单独的鼠标。 * p < 0.05; ** p < 0.01, ** p < 0.001(Mann-Whitney 检验或采用 Tukey 检验后分析的方差分析)。
抗 CD137 对免疫监视和抗 PD1 功效的对比作用
最后,作者想确定全身抗 CD137 治疗诱导的Tex细胞积累是否可能影响体内抗肿瘤免疫监视。为了解决这一点,在用 B16K1 攻击之前,用抗 CD137 mAb对 WT 小鼠进行了 3 周的预处理(图 7A)。与 Ig 对照相比,抗 CD137 预处理增加了肿瘤负荷(图 7B)。这些结果在 B16F10 和 VK12653 模型中得到了证实(图 S7A-S7C)。与 Ig 对照相比,注射 B16K1 前 4 天的短暂抗 CD137 处理足以增加肿瘤生长,证实抗 CD137 诱导的Tex细胞扩增可能会限制抗肿瘤功效(图 7A)。将来自接受抗 CD137 mAb处理的 OT-1 小鼠的 PD1+ Tex或 PD1− Tmem细胞过继转移到注射 B16-ova 的 Rag2−/−Il2rg−/− 小鼠中,证实了经抗 CD137 处理后扩增的Tex细胞具有较低的抗肿瘤功能优于其Tmem对应物(图 7C 和 7D)。抗 PD1 治疗只能部分逆转抗 CD137 治疗引起的功能障碍(图 S7D)。事实上,抗PD1治疗减少了抗CD137预处理小鼠的肿瘤生长,尽管与单独的抗PD1治疗相比,抗PD1功效仍然降低(图S7D)。越来越多的证据支持, DLN 中Tpex细胞的激活,而不是TermTex细胞的重生,是抗 PD1 功效的关键机制。23 ,50,72鉴于 CD137 刺激驱动 CD8+ Tex细胞扩增的能力,作者推断表明在抗 PD1单克隆抗体之后注射抗 CD137 激动剂可能具有更好的疗效。为了解决这个问题,用抗 PD1、抗 CD137 或两种mAb的组合治疗具有可检测到的 B16K1 或 B16-ova 肿瘤的 WT 小鼠(图 7E)。对已形成的肿瘤进行抗 PD1 治疗(第 9 天)限制了肿瘤进展,但不足以促进肿瘤消退(图 7F 和 7G)。同样,与之前的报道一致,当注射到已建立的肿瘤上时,抗 CD137 在减少肿瘤生长方面效果不佳。 73 相反,与抗 PD1 相比,在抗 PD1 治疗后给予抗 CD137 治疗可减少肿瘤负荷并延长生存期。 B16-ova 模型和 B16K1 模型(图 7F 和 7G)。值得注意的是,抗 PD1 药物限制了 Cd137−/− 和 Cd137+/+ 小鼠的肿瘤进展(图 S7E-S7G)。虽然作者尚未排除全身性 CD137 激动剂注射引发的 Tex 细胞积聚可能有利于肿瘤复发并限制随后的免疫治疗干预,但抗 PD1 和抗 CD137 的组合可明显增强模型中的肿瘤排斥作者已经检查过。
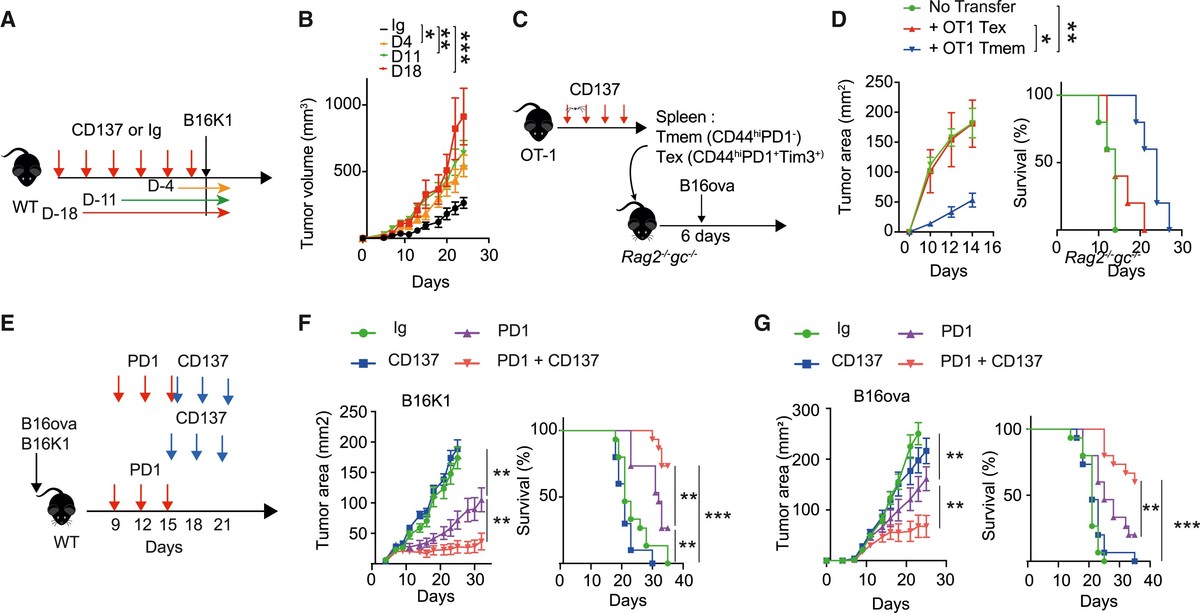
图7 抗CD137对免疫监测和抗PD1疗效的对比研究
(A 和 B)用抗 CD137(10 μg ;3H3,腹膜内注射,每周两次)或对照 IgG 处理 C57BL/6 WT 小鼠指定的时间。实验设计 (A) 和肿瘤体积 (B)。 (n = 5/组)。
(C 和 D)从用抗 CD137 (100 μg ;3H3,腹膜内注射,每周两次)处理 18 天的OT-1 小鼠中进行 FACS 分选脾脏Tmem和Tex细胞,并转移至 Rag2−/−Il2rg−/− 小鼠中随后注射 B16-ova 肿瘤细胞。 (C) 实验设计。 (D) 指定小鼠组的肿瘤面积和存活率。 (n = 每组 5 只小鼠,来自一项实验。)
(E–G) C57BL/6 WT 小鼠注射 B16K1 (F) 或 B16-ova (G),并从第 9 天开始用 IgG 对照、抗 CD137(10 μg;3H3,腹膜内注射。每周两次)进行治疗,抗 PD1(250 μg ip ., RMP1–14) 或两者。 (E) 实验设计。 (F 和 G) 指定小鼠组的肿瘤面积和存活率。 (n = 10–15/组)。除非另有说明,数据以至少 2 个独立实验的平均值±SEM 表示。每个符号代表一只单独的鼠标。 * p < 0.05; ** p < 0.01, ** p < 0.001(Mann-Whitney、Mantel-Cox 对数秩或采用 Tukey 检验后分析的方差分析) 。
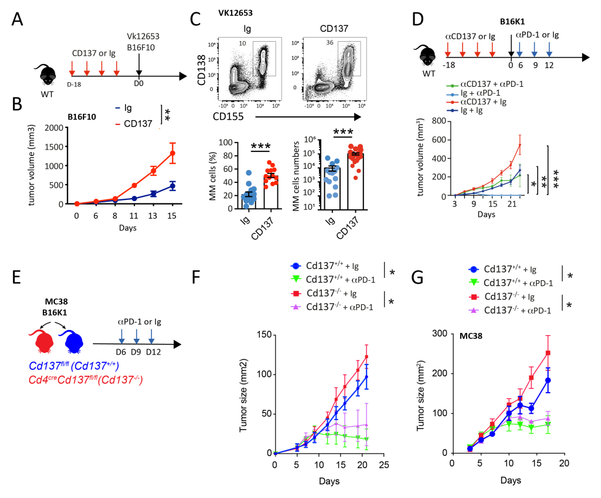
图S7:抗CD137对免疫监测和抗PD1疗效的对比作用。
(A-C)用抗CD137(10µg;3H3,每周腹腔注射两次)或对照IgG治疗WT小鼠3周,并用B16F10(B)或Vk12653多发性骨髓瘤细胞(C)攻击。(A) 实验设计。(B) 肿瘤生长曲线(n=5/组)。(C) 恶性浆细胞(CD155)的频率和数量⁺CD138⁺). (n=12-15只小鼠/组,来自2个独立实验)。(D) 注射抗CD137(10µg;3H3,每周腹腔注射两次)或IgG对照18天的WT小鼠用B16K1攻击。小鼠在第6、9、12天用cIg(250µg i.p.)或抗PD1(250µgi.p.,RMP1-14)处理。所示小鼠组的肿瘤生长曲线。(n=5/代表2个实验的组)。用B16K1或MC38细胞皮下注射(E-G)Cd4cre Cd137fl/fl(Cd137-/-)和Cd137fl/fil(Cd137+/+)。小鼠在第6、9、12天用cIg(200µg i.p.)或α-PD-1(200µgi.p.,RMP1-14)处理。实验设计(E)和所示小鼠组中的B16K1(F)或MC38(G)肿瘤生长曲线(n=5/代表2个实验的组)。数据以平均值±SEM表示,每个符号代表一只小鼠。多组之间的统计差异通过单因素方差分析确定,并对多项测试进行校正,两组之间的差异使用Mann-Whitney检验进行评估*p<0.001。
参考文献:
1. Pichler, A.C., et al., TCR-independent CD137 (4-1BB) signaling promotes CD8+-exhausted T cell proliferation and terminal differentiation. Immunity, 2023. 56(7): p. 1631-1648.e10.
本文仅作信息分享,不代表礼进生物公司立场和观点,也不作治疗方案推荐和介绍。如有需求,请咨询和联系正规医疗机构。




 沪公网安备 31011502015333号
沪公网安备 31011502015333号