

学习资源
科普文章
癌症免疫治疗的三特异性抗体[1]
尽管单克隆抗体和双特异性抗体在临床取得了成功,但对恶性肿瘤的治疗效果仍然存在局限性,如反应率低、治疗耐药等,这也启发了对三特异性抗体(trispecific antibodies,TsAbs)的探索。TsAbs通过将三个靶点组合和结构优化,进一步提高了安全性和有效性,具有更好的临床应用价值潜力。虽然TsAbs在临床应用中仍存在很大的挑战,不可否认的是,TsAbs可能发展成为一个具有突破性进展的抗体药物。本文基于一篇综述,介绍了目前开发的TsAbs结构形式。
免疫检查点抑制剂(ICI)自最初被批准用于黑色素瘤以来,改变了肿瘤治疗的前景。虽然在部分患者中展示出持久有效的抗肿瘤能力,但大多数患者仍然对单药ICI无反应,表现出初级或二级治疗耐药性。
已有多项研究在开展ICI的联合方案来克服耐药性问题,在多个III期临床试验中,ICI-化疗和ICI-抗血管生成偶联剂取得了成功。ICI-ICI联合疗法也得到了广泛的试验,其中nivolumab(抗PD -1)和ipilimumab(抗CTLA-4)在黑素瘤和肾细胞癌(RCC)中取得了初步成功;然而,除了抗PD -1/PD-L1和抗CTLA-4组合外,结果尚不尽人意。Pembrolizumab联合epacadostat(吲哚胺-2,3双氧合酶-1抑制剂)在晚期黑色素瘤的III期研究中产生阴性结果,SKYSCRAPER-02在未经治疗的不同期小细胞肺癌中也产生阴性结果,在carboplatin、etoposide和atezolizumab的标准方案中添加tiragolumab(抗TIGIT)未能改善无进展或总生存。然而,最近批准的靶向淋巴细胞激活基因3 (LAG3)的relatlimab联合nivolumab治疗晚期黑色素瘤,以及zimberelimab(抗PD -1)联合domvanalimab(抗TIGIT)在PD-L1高表达的非小细胞肺癌随机II期arc7的中期结果逆转了这一趋势,为ICI-ICI联合治疗作为克服治疗耐药性的可行方法带来了新的希望。
Desai等人介绍了他们的I/II期研究,即单独抗PD-L1单抗 BGB-A333 (Ia期)和联合抗PD-1 单抗tislelizumab (Ib/II期)。这种新组合的安全性和耐受性似乎与其他抗PD-1 /PD-L1组合研究一致,但应注意的是,在Ib/II期组中存在2例与治疗不良事件相关的患者死亡(n = 24)。II期研究纳入了前期治疗但未接受免疫治疗的晚期尿路上皮癌(UC)患者,总缓解率(ORR)为41.7%。在交叉试验比较中,与报道的晚期UC单药tislelizumab(24%)或pembrolizumab(21%)的OR相比,有一定程度提高,但受到样本量小和单臂设计的限制。
在未来的UC治疗中,一个至关重要的问题仍然是这种组合的定位,许多患者在经过铂化疗后使用avelumab(抗PD-L1)作为切换维持治疗,而一线组合的enfortumab vedotin(一款靶向nectin-4的ADC)和pembrolizumab即将出现(EV-302 III期试验正在进行)。未满足的需求仍然是患者(UC和非UC)在单药抗PD-L1 /抗PD-1治疗中的进展。然而,这类患者被排除在本研究之外。有限的证据表明抗PD-L1联合 抗PD-1药物优于单一药物治疗,此前的MEDI0680(抗PD-1)联合durvalumab(抗PD-L1)的研究未能在晚期免疫治疗初治RCC中优于单独nivolumab。
从科学的角度来看,抗PD-1与抗PD-L1的双重阻断原理一直存在矛盾。PD-L1和PD-L2都是PD-1的配体,在抗PD-L1治疗后,PD-L2表达上调,提示添加抗PD-1治疗可增强PD-1信号通路阻断。然而,单独使用抗PD-1治疗应该会阻断两种配体的信号,考虑到潜在的毒性,这种特定组合的必要性存在质疑。有其他报告的结论不同,有临床前证据表明PD-L1和PD-1在抗原提呈细胞上共表达。只通过抗PD-1单独抑制,允许PD-L1与T细胞上表达的PD-1相互作用,导致免疫抑制信号。此外,PD-L1已被证明与B7-1 (CD80)相互作用,通过抗PD-L1的使用阻断这种相互作用,可能会增加B7-1- CTLA-4抑制信号。鉴于目前可用的免疫治疗药物众多,考虑与免疫调节周期中的其他途径结合可能更有吸引力。
克服ICI耐药的新型联合策略正在迅速发展(图1),目前正在进行大量临床试验。双特异性抗体(bsAbs)利用单个分子同时作用两种特定的耐药机制,PD-L1和LAG-3的双检查点抑制双特异性抗体就是一个例子,显示出有潜力的临床前结果。其他bsAb利用ICI与非ICI免疫治疗组合,如PD-L1抗体和转化生长因子-β (TGF-β),在肿瘤微环境(TME) 免疫抑制的发展中发挥关键作用。
与其他形式的非ICI免疫疗法联合使用也取得了不错的效果,包括免疫刺激细胞因子(如重组白细胞介素-2、干扰素-α)、癌症疫苗和过继细胞疗法。在临床前模型中,联合ICI的疫苗治疗增强了抗肿瘤作用,在一项联合人乳头瘤病毒-16 (HPV16)特异性肽疫苗和nivolumab治疗晚期HPV16阳性恶性肿瘤的II期研究中, ORR为33%。嵌合抗原受体(CAR) T细胞疗法在特定的复发/难治性恶性血液肿瘤中显示出显著的益处,但在实体器官肿瘤中治疗效果有限。CAR-T联合ICI可能会克服遇到的一些问题,在小鼠胶质母细胞瘤模型中,这种联合导致肿瘤浸润淋巴细胞增加,其他早期临床试验显示出有希望的效果。
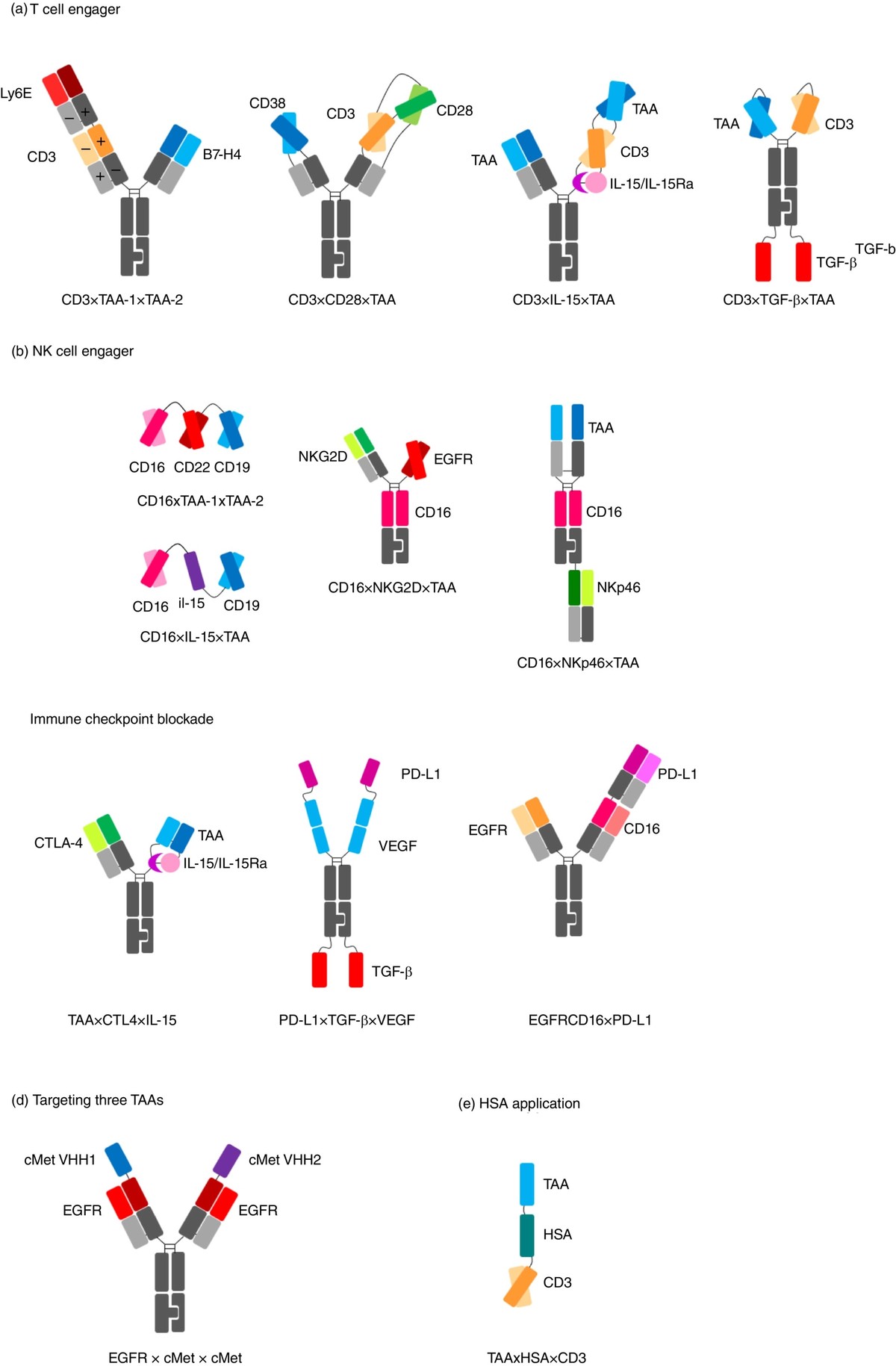
图1. TsAb结构示意图。
表 1.截止至2022年11月处于临床阶段的三/四特异性抗体。[2]
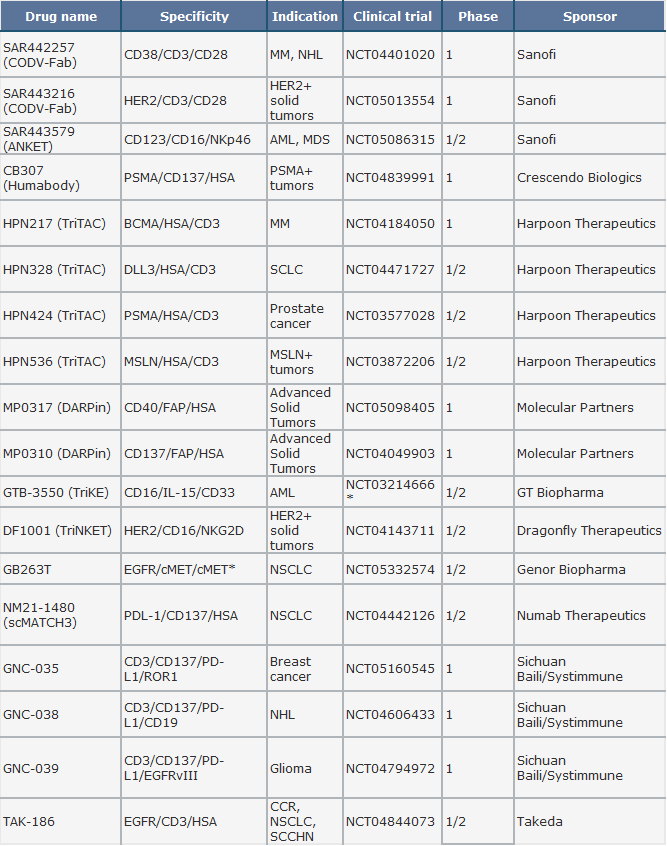
*Terminated, due to development of the second-generation TriKE GTB-3650.
本文仅作信息分享,不代表礼进生物公司立场和观点,也不作治疗方案推荐和介绍。如有需求,请咨询和联系正规医疗机构。
参考文献:
1. Yao, Y., Y. Hu, and F. Wang, Trispecific antibodies for cancer immunotherapy. Immunology.
2. Tapia-Galisteo A, Compte M, Álvarez-Vallina L, Sanz L. When three is not a crowd: trispecific antibodies for enhanced cancer immunotherapy. Theranostics 2023; 13(3):1028-1041.
礼进生物(Lyvgen Biopharma)的网站(中文)
礼进生物创建于2016年,以其全球创新的肿瘤免疫激动性抗体管线为核心,凭借其世界级的研发团队,最前沿的药物研发项目,以及开放式创新的策略, 有望引领国内新药研发行业走向全球。
https://user-assets.sxlcdn.com/images/676507/FiTA8WK-FQRyXrQDyd-HDkY3tpfI.png?imageMogr2/strip/auto-orient/thumbnail/1200x630>/format/png



 沪公网安备 31011502015333号
沪公网安备 31011502015333号