

学习资源
科普文章
克服癌症中CD3+ T细胞重定向相关的挑战[1]
双/多特异性抗体的构型format对于抗体的各个功能参数有重要影响,本文是关于综述Dickopf, S.et al, Format and geometries matter: Structure-based design defines the functionality of bispecific antibodies. Computational and Structural Biotechnology Journal, 2020. 18: p. 1221-1227摘译的第二部分,上期微信第一部分讨论了抗体format对于不同作用机制的影响,包括:1)受体激活;2) 受体阻断,抑制其与配体的结合,配体可能是可溶性的或者在效应细胞 (E)膜表达上的;3) 受体内化;4) 受体集聚;5) 受体结合;6) 效应细胞 (E) 的重定向,与目标细胞的结合,具体可参考:构型Format的重要性:几何结构定义了双特异性抗体的功能(一)
泛T细胞群的招募
CD3+双特异性T细胞接合物通过将所有T细胞群重定向到癌细胞来促进有效的肿瘤细胞杀伤。然而,与多克隆T细胞激活和重定向相关的一些缺点,包括招募“反作用”CD3+ T细胞亚群,如幼稚/耗尽T细胞,调节性T (TREG)细胞和其他CD4+ T细胞群。事实上,有研究表明blinatumomab的耐药性归因于CD3+ CD4+ CD25hi FoxP3+ TREG细胞的激活和招募,这些细胞已被证明可以抑制T细胞增殖并阻碍CD8+介导的肿瘤细胞溶解,最终影响blinatumomab治疗前体B细胞ALL患者的疗效。除TREG细胞外,过量招募其他CD4+ T细胞群,包括辅助T (TH)细胞亚群TH1和TH17,可能是有害的,因为这些细胞可以在微环境中快速分泌细胞因子,造成会导致严重的免疫相关不良事件,如细胞因子风暴。
提高T细胞招募双特异性抗体的选择性
CD8+细胞毒性T淋巴细胞(CTL)被称为免疫系统的步兵,与非特异性的泛CD3+ T细胞重定向相比,选择性招募CD8+细胞毒性T淋巴细胞(CTL)是一种更有效的方法来驱动有效的抗肿瘤免疫反应,因为专业CD8+ CTL配备有穿孔素/颗粒酶,可以在与肿瘤细胞交联后立即启动杀伤。为了测试这种方法而构建的一种针对CD8共受体和前列腺干细胞抗原(PSCA)的双特异性抗体能够有效地只激活预先激活的CD8+ T细胞,并将其重定向到肿瘤细胞溶解中——然而新分离的CD8+ T细胞不能被激活/重定向——因此表明了预激活和共连接在诱导选择性肿瘤杀伤中的重要性。组织常驻记忆(TRM) CD8+ CD69+ CD103+ T细胞表型也已成为选择性重定向肿瘤细胞的重要T细胞群,因为这种记忆CD8+ T细胞亚群表达高水平的细胞毒性分子,并与癌症的良好临床结果相关。Menares等人还在2019年证明了TRM T细胞和树突状细胞之间的相互作用,可放大CD8+ CTL介导的抗肿瘤免疫反应。鉴于这些结果,目前研发方向在于如何提高T细胞招募双特异性抗体的选择性,以便有利于更有效的杀伤肿瘤细胞,同时降低毒性。
细胞因子释放综合征
细胞因子释放综合征是一种严重的免疫反应,其特征是促炎细胞因子的快速全身释放,包括白细胞介素(IL)-6、IL-10、肿瘤坏死因子-α (TNF-α)和干扰素-γ (IFN-γ)。这些核心细胞因子水平的升高会诱导免疫细胞产生过量的额外细胞因子,产生一种被放大的现象,称为“细胞因子风暴”。这种免疫相关的不良事件在嵌合抗原受体(CAR)-T细胞治疗或T细胞重定向治疗中经常被观察到,并且在CD3+ T细胞重定向的背景下提出了一个重大挑战,因为注入的双特异性抗体不加选择地与所有可用的T细胞结合,导致细胞因子的大量释放。事实上,blinatumomab和FDA批准的两种CAR-T细胞疗法,tisagenlecleucel (Kymriah)和axicabtagene ciloleucel (Yescarta),已被证明可诱导白血病和淋巴瘤患者的细胞因子释放综合征。细胞因子释放综合征的临床表现包括发热、疲劳、肌痛、呼吸窘迫、毛细血管渗漏、血管扩张性休克,最终导致器官系统功能衰竭。带有抗CD3 ×抗HER2或抗CD3 ×抗表皮生长因子受体(EGFR)双特异性抗体的CD19-CAR-T细胞已被开发用于解决细胞因子释放综合征(图1)[2]。这种方法是自我限制的,并具有降低细胞因子风暴发生风险的潜力。
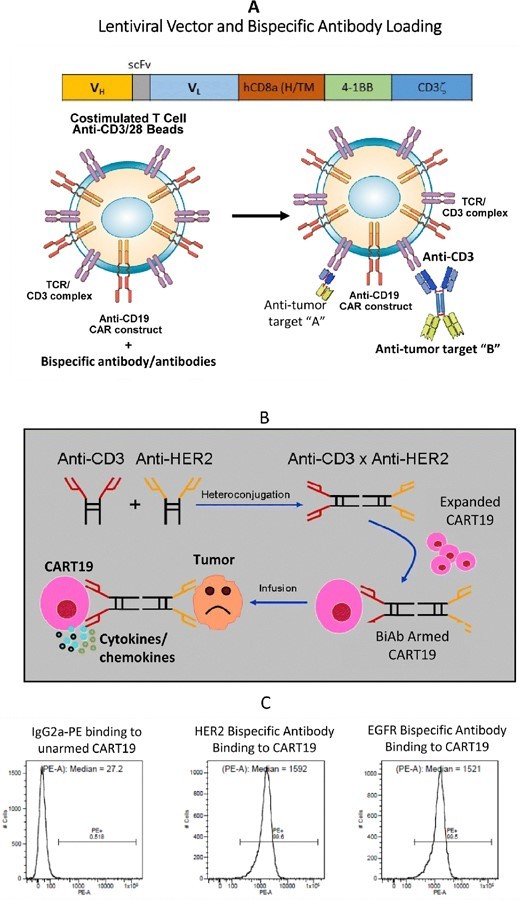
Figure 1.
A) A basic structure for a CART19 scFv and intracellular signaling domain. The chimeric intracellular signaling molecule includes a human CD8α hinge/ transmembrane domain, and intracellular 4–1BB and CD3z domains. B) Cartoon showing production of the BiAb by chemical heteroconjugation of whole IgG molecules using complementary linkers at the Fc region of the IgG. CART19 cells armed with BiAb can exhibit non-MHC restricted cytotoxicity against target cells and produce cytokines/chemokines. C) Flow cytometry analysis showing binding of BiAb when CART19 cells were armed with either HER2Bi or EGFRBi by detecting OKT3 on CART19 cells.
图1
A) CART19单链抗体和细胞内信号域的基本结构。嵌合细胞内信号分子包括一个人CD8α铰链/跨膜结构域,以及细胞内4-1BB和CD3z结构域。B)示意图展示了在IgG的Fc区域使用互补连接剂,通过整个IgG分子的化学异偶联产生BiAb。携带BiAb的CART19细胞可以对靶细胞表现出非MHC限制性细胞毒性,并产生细胞因子/趋化因子。C)通过检测CART19细胞上的OKT3,流式细胞术分析显示当CART19细胞被HER2Bi或EGFRBi武装时,BiAb结合。
免疫检查点分子表达
抑制性检查点分子和刺激性检查点分子相互作用,以确保免疫系统可以对“异物”产生反应,但这种反应在类型、大小和持续时间方面是受控制的,以保持自我耐受性并防止自身免疫。众所周知,T细胞或肿瘤细胞表面表达的抑制性分子可以促进T细胞功能障碍和衰竭,导致抗肿瘤免疫反应被抑制。这种共抑制性免疫检查点分子的例子包括程序性死亡-1 (PD-1),程序性死亡配体1 (PD-L1),细胞毒性T淋巴细胞相关抗原-4 (CTLA-4), T细胞免疫球蛋白和粘蛋白域含蛋白3 (TIM3),淋巴细胞激活基因3 (LAG3)和具有免疫球蛋白和ITIM结构域的T细胞免疫受体(TIGIT)。在具有TRM表型(具有直接抗肿瘤免疫活性)的CD8+ CD69+ CD103+人T细胞中观察到免疫检查点受体表达的富集,抗PD -1治疗导致这种T细胞在黑色素瘤患者中显著增加。此外,抗PD -1治疗被证明可以增强黑色素瘤小鼠模型中组织常驻CD8+记忆T细胞的浸润。
CD3+双特异性T细胞重定向联合免疫共抑制检查点阻抗剂
组合免疫治疗方法已被设计用于使用共抑制性检查点阻断抗体来抵消T细胞功能障碍/衰竭的机制,以改善接受CD3+双特异性T细胞重定向治疗的个体的临床结果。有趣的是,对blinatumomab治疗的耐药性被归因于CD19+白血病细胞上PD-L1表达的增加。自这一发现以来,已经启动了许多评估blinatumomab联合pembrolizumab(抗PD -1治疗)治疗淋巴瘤或白血病的安全性和有效性的临床试验(NCT03160079, NCT03605589, NCT03340766, NCT03512405)。此外,临床正在研究在blinatumomab治疗中添加双重免疫检查点阻断(例如,blinatumomab和nivolumab(抗PD -1抗体)联合或不联合ipilimumab(抗CTLA -4抗体)治疗白血病的一期试验(NCT02879695)。Herrmann, M.等人通过将双特异性CD33-CD3ε单链抗体融合到人PD-1的内源性细胞外结构域(PD-1ex),成功生成CiTE抗体构建物(图2)[3]。这种双功能检查点抑制T细胞接合物(CiTE)将T细胞重定向到CD33(在急性髓系白血病(AML)细胞上表达),并通过PD-1的细胞外结构域与PD-L1弱结合,阻断PD-L1与T细胞上PD-1的接合,在减轻AML患者的适应性免疫逃逸方面表现出早期临床前效果[4]。
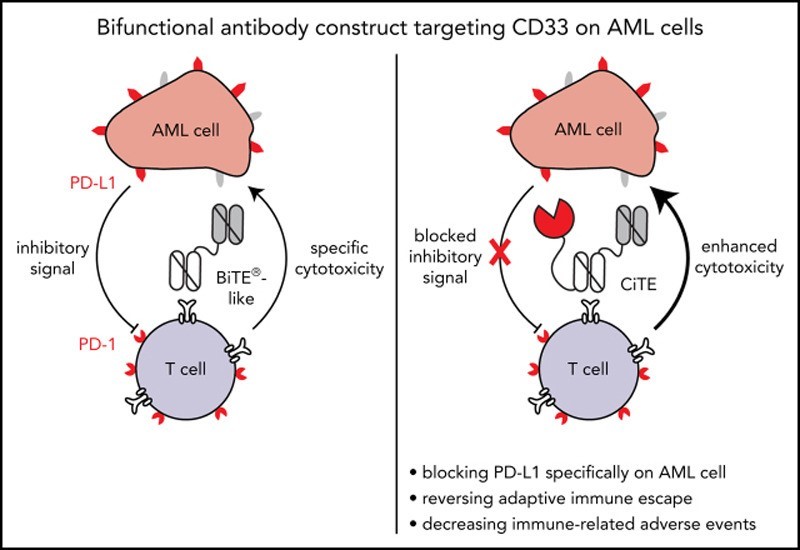
Figure 2.
Bifunctional checkpoint inhibitory T cell–engaging (CiTE) antibody that combines T-cell redirection to CD33 on AML cells with locally restricted immune checkpoint blockade. This is accomplished by fusing the extracellular domain of PD-1 (PD-1ex), which naturally holds a low affinity to PD-L1, to an αCD3.αCD33 BiTE-like scaffold.
图2.
双功能检查点抑制T细胞接合(CiTE)抗体结合了AML细胞上的T细胞重定向到CD33和局部限制性免疫检查点阻断。这是通过将PD-1的胞外结构域(PD-1ex)融合到αCD3.αCD33 BiTE-like支架来实现的,PD-1天然对PD-L1具有低亲和力。
值得注意的是,抗CD3 ×抗PD -1 ×抗HIV和抗CD3 ×抗TIGIT ×抗HIV三功能T细胞接合物在shiv感染的恒河猴中证明了增强CD8+ T细胞效应功能的功效[5];这个模型可能也适用于癌症。免疫检查点抑制加上CD3+双特异性T细胞重定向也已在实体肿瘤中进行了研究。MGD007(抗CD3 ×抗gpA33双特异性抗体)联合MGA012(抗PD -1抗体)的安全性和有效性目前正在转移性结直肠癌的1/2期临床试验(NCT03531632)中进行研究。定量系统药理学模型和生物标志物策略显示,由抗CD3 ×抗CEA双特异性抗体和抗PD - L1治疗组成的联合治疗可增强结直肠癌患者的抗肿瘤活性[6]。
下期微信小文会介绍CD3双抗与免疫共刺激靶点抗体的临床联用探索,敬请读者关注。
本文仅作信息分享,不代表礼进生物公司立场和观点,也不作治疗方案推荐和介绍。如有需求,请咨询和联系正规医疗机构。
参考文献1.Singh, A., S. Dees, and I.S. Grewal, Overcoming the challenges associated with CD3+ T-cell redirection in cancer. British Journal of Cancer, 2021. 124(6): p. 1037-1048.
2.Thakur, A., et al., Enhanced cytotoxicity against solid tumors by bispecific antibody-armed CD19 CAR T cells: a proof-of-concept study. J Cancer Res Clin Oncol, 2020. 146(8): p. 2007-2016.
3.Herrmann, M., et al., Bifunctional PD-1 × αCD3 × αCD33 fusion protein reverses adaptive immune escape in acute myeloid leukemia. Blood, 2018. 132(23): p. 2484-2494.
4.Herrmann, M., et al., Development of a Bifunctional Checkpoint Inhibitory T Cell Engager (CiTE) to Reverse Adaptive Immune Escape in AML. Blood, 2018. 132(Supplement 1): p. 4069-4069.
5.Promsote, W., et al., Tri-functional T-cell engagers target immune checkpoint inhibitors PD-1 and TIGIT to enhance CD8 effector T-cell functions in chronically SHIV-infected rhesus macaques. The Journal of Immunology, 2020. 204(1_Supplement): p. 169.31-169.31.
6.Ma, H., et al., Combination therapy with T cell engager and PD-L1 blockade enhances the antitumor potency of T cells as predicted by a QSP model. Journal for ImmunoTherapy of Cancer, 2020. 8(2): p. e001141.



 沪公网安备 31011502015333号
沪公网安备 31011502015333号