

学习资源
科普文章
激动性抗 PD-1 抗体开启 PD-1 的免疫抑制活性 [1]
阻断 PD-1/PD-L1 相互作用的抗体被广泛用于癌症免疫治疗,这类抗体与 PD-1 分子的膜远端区域结合,抑制PD-1活性,增强抗肿瘤免疫功能。在最近发表在《科学免疫学(Science Immunology)》杂志上的一篇论文中,Suzuki 和 Tajima 等人确定了另一类识别 PD-1 近膜细胞外区域的抗 PD-1 抗体。这些抗体作为激动剂,在小鼠模型中抑制炎症,并可能具有作为治疗各种炎症性疾病(包括自身免疫性疾病)的药物的潜力。
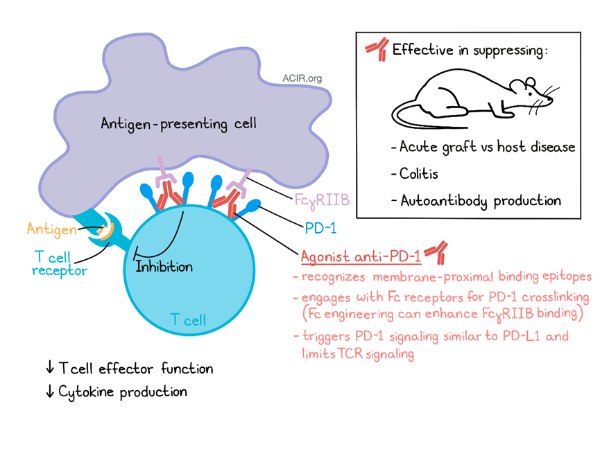
激动性抗 PD-1 抗体开启 PD-1 的免疫抑制活性原理示意图[1]
Suzuki 和 Tajima 等人首先证实,为了达到激活PD-1从而抑制 T 细胞功能的目的,通过固定化 PD-L1-Fc 以及抗 CD3 和抗 CD28 抗体,实现 PD-1 和 TCR 的共定位和共连接是必需的。然而,当利用PD-1 结合抗体来替换 PD-L1 Fc,促成PD-1 和 TCR 的共连接时,并没有达到和PD-L1 Fc相同的效果,这表明结合位点的重要性。
研究人员在 PD-1 的 N 端 N 环中串联引入了一个 FLAG 标签(FLAG-hPD-1),或者用 FLAG 标签替换了部分 PD-1 茎区(hPD-1 stalk FLAG),以研究引导到 PD-1 分子这些区域的抗 FLAG 抗体是否可以刺激其免疫抑制活性。在使用共固定化抗 FLAG、抗 CD3 和抗 CD28 抗体的测试中,IL-2 的下调发生在转染了hPD-1 stalk FLAG而不是 FLAG-hPD-1 或野生- hPD-1 型的DO11.10细胞中,表明识别茎区(stalk)可能对刺激 PD-1 的免疫抑制活性很重要。
Suzuki 和 Tajima 等人利用 PD-1 敲除的 I-Ad 限制性 T 细胞系 DO11.10(其在用 OVA323-339 激活的 IIA1.6 B淋巴瘤细胞刺激后会产生 IL-2)进行细胞层面的检测。当用野生型 hPD-1、FLAG-hPD-1 或 hPD-1 stalk FLAG 转染的 DO11.10 细胞用于此测定时,由于与 IIA1.6 细胞上表达的 PD-L1 与PD-1相互作用,DO11.10细胞受到抑制,表现为IL-2分泌下调。然而,当使用 PD-L1-IIA1.6 细胞进行测定并添加抗 FLAG抗体时,未观察到对转染的 DO11.10 细胞产生 IL-2 的影响,这导致作者推测需要表达在抗原呈递细胞上的Fc 受体来帮助抗 FLAG抗体,或者激动性抗 PD-1 抗体,稳定在免疫突触处,并促使 PD-1 和 TCR 的共连接。
接下来,研究人员用亲本 A20 细胞替换了 Fcγ 受体缺陷型 IIA1.6 细胞,正如预期的那样,观察到添加抗 FLAG 抗体后,表达 hPD-1 stalk FLAG 的 DO11.10 细胞产生的 IL-2 减少。在细胞内结构域 (Y248F) 中引入关键突变的实验证实,h hPD-1 stalk FLAG与抗 FLAG 抗体的结合触发了与 PD-L1 相同的 PD-1 信号通路。 此外,在共连接研究中,使用 PD-1 的 N 环和 IgV 区域缺失的鼠源PD-1 stalk FLAG不抑制 DO11.10 T 细胞,表明N 环和 IgV 区域的结构域也是免疫抑制活性所必需的。
为了能够筛选激动性抗 hPD-1 抗体,Suzuki 和 Tajima 等人设计了两个测定体系:“阻断抗体测定”(hPD-1+ DO11.10 细胞加 Fc 受体缺陷型 hPD-L1+ IIA1.6 细胞)和“激动剂抗体测定”(hPD-1+ DO11.10 细胞 加上 mFcγRIIB+ hPD-L1- IIA1.6 细胞)。研究人员评估了一组具有不同结合表位的 81 种抗 hPD-1 抗体与 hPD-1 结合的能力。此外,他们将hPD-1 细胞外结构域的八个不同片段分别与相应的 mPD-1 片段交换,利用这些杂合 PD-1 分子来评估每个抗 hPD-1 抗体与PD-1的结合表位,并进行分类。这样,Suzuki 和 Tajima 等人鉴定了抗 hPD-1 阻断抗体会结合到 hPD-1 的膜远端区域(membrane-distal region),而具有强免疫抑制活性的激动性抗体则识别 hPD-1 的膜近端细胞外区域 (membrane-proximal extracellular region,MPER)。
与 PD-1 分子茎区域近端的片段 #7 结合的激动性抗体克隆 HM266(小鼠 IgG1),被选择用于进一步表征。HM66 不干扰 PD-L1 或 PD-L2 与 PD-1 的结合,并且与 PD-L1的抑制功能相叠加。免疫抑制的强度直接取决于 T 细胞表面的 PD-1 水平和抗原呈递细胞上的 FcγRIIB 水平。HM266 对 PD-1 的刺激导致 TCR 信号下调和防止DO11.10 中 ERK 的磷酸化,这与 PD-L1 的刺激效果类似。
转向人体系统,Suzuki 和 Tajima 等人合成了 HM266 嵌合人 IgG1 和 IgG4 的版本,并在人源 CD4+ T 细胞和 THP-1 细胞(具有 APC 特性的单核细胞系)的共培养体系中测试了抗体,并监测了 IFNγ 的产生。 研究人员观察到 IFNγ的分泌减少,且这一抑制作用与过表达 hFcγRIIB 的 THP-1 细胞共培养时显著增强。HM266 的免疫抑制活性可通过使用对 hFcγRIIB 具有增强亲和力的 hIgG1 Fc 变体 (HM266-hIgG1-X4) 进一步增强。在混合淋巴细胞相互作用的实验中,HM266-hIgG1-X4 抑制了同种异体 T 细胞对健康供体原代 B 细胞的反应。
在将脾细胞从 C57BL/6 人 PD-1 敲入小鼠转移到 B6D2F1 小鼠诱导的急性移植物抗宿主病小鼠模型中,HM266 (mIgG1) 治疗减少了 H-2b+ H-2d- 供体衍生的 T 细胞——其中许多是 hPD-1+——在宿主小鼠中,并防止体重减轻。在通过将原始 hPD-1 敲入 CD4+ T 细胞转移到 RAG2-/- 小鼠中创建的结肠炎模型中,HM266 治疗减少了固有层中 CD4+ T 细胞的扩增和在固有层和肠系膜淋巴结中致病效应细胞(产生IFNγ和 /或IL-17 的 CD4+ T 细胞)的扩增。 在 HM266 处理后,该模型中预防结肠炎的作用还进一步表现为避免体重减轻和结肠长度缩短。
最后,研究人员还展示了激动性抗 PD-1 对体液免疫反应的影响。在用明矾中的 4-羟基-3-硝基苯基乙酰基-卵清蛋白 (NP-OVA) 免疫 hPD-1 敲入小鼠后,用 HM266 处理降低了 OVA 特异性血浆抗体水平。 为了排除 T 细胞耗竭的影响,用 HM255(一种与 PD-1 具有相似结合亲和力但无激动活性的 IgG1 抗 PD-1 抗体)处理并未消除 OVA 特异性抗体的产生。这些发现可能与自身抗体产生的药物调节相关。
除了在癌症免疫治疗中的应用外,PD-1 还是一个有趣的药物靶点,可用于免疫调节多种炎症性疾病。了解抗体如何调节 PD-1 活性对于抗 PD-1 疗法的转化应用很重要。铃木和田岛等人证实了激动性抗 PD-1 抗体结合 PD-1 的膜近端区域,并与抗原呈递细胞上的 Fc 受体结合,促成PD-1交联和抑制信号的传递。这些发现可能有助于开发激动性抗 PD-1 抗体作为免疫抑制剂,用于治疗各种炎症性疾病。
Write-up and image by Ute Burkhardt [1]
Figures from the original Suzuki K, et al. paper [2]:
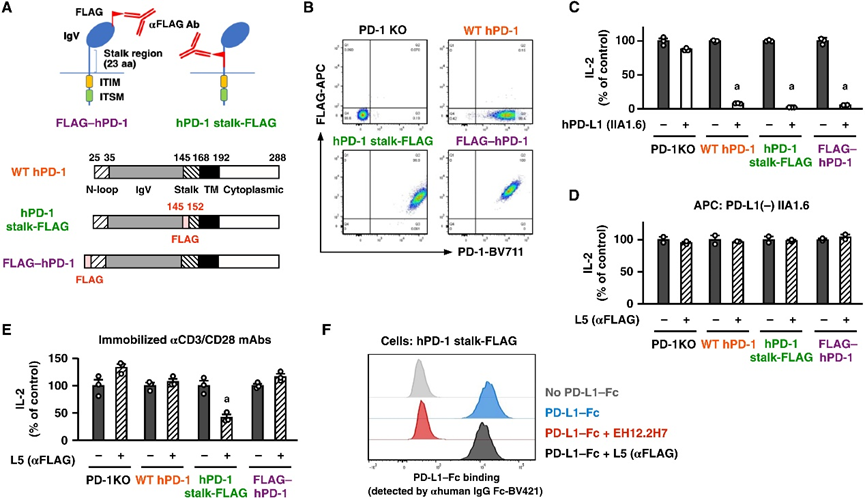
Fig. 1. PD-1 signaling was inducible by guided antibody binding to the stalk region of the PD-1 molecule. (A) Introduction of FLAG tag to hPD-1: replacement of a part of the stalk region (hPD-1 stalk-FLAG) or FLAG addition to the N terminus (FLAG–hPD-1). (B) FLAG tag detection by anti-FLAG mAb L5 in DO11.10 cells transduced with wild-type hPD-1 (WT hPD-1) or FLAG-tagged hPD-1. (C) Immunosuppressive potential of FLAG-tagged PD-1. PD-1–transduced DO11.10 cells were stimulated with OVA323–339 in the presence of IIA1.6 cells either devoid of or expressing PD-L1 (see also fig. S2). (D) The addition of L5 in the soluble form (5 μg/ml) to PD-1–transduced DO11.10 cells. (E) Stimulation of PD-1–transduced DO11.10 cells by anti-CD3 mAb (0.5 μg/ml), anti-CD28 mAb (0.5 μg/ml), and L5 (3 μg/ml). (F) PD-L1–Fc (10 μg/ml) binding to hPD-1 stalk-FLAG. The antibody concentration was 5 μg/ml. EH12.2H7 is an anti–hPD-1 blocking mAb. Data represent average ± SE of triplicate (C and E) or duplicate (D) samples. a, P < 0.05 versus controls (two-tailed Student’s t test). αFLAG, anti-FLAG; aa, amino acids; ITIM, immunoreceptor tyrosine-based inhibitory motif; ITSM, immunoreceptor tyrosine-based switch motif; TM, transmembrane segment; WT, wild type, KO, knockout.
图 1. PD-1 信号通过引导抗体结合到 PD-1 分子的茎区而被诱导。(A) 将 FLAG 标签引入 hPD-1:替换部分茎区域 (hPD-1 stalk-FLAG) 或将 FLAG 添加到 N 末端 (FLAG–hPD-1)。(B) 在用野生型 hPD-1 (WT hPD-1) 或 FLAG 标记的 hPD-1 转导的 DO11.10 细胞中通过抗 FLAG mAb L5 检测 FLAG 标记。(C) FLAG 标记的 PD-1 的免疫抑制潜力。在缺乏或表达 PD-L1 的 IIA1.6 细胞存在的情况下,用 OVA323-339 刺激 PD-1 转导的 DO11.10 细胞(另见图 S2)。(D) 向 PD-1 转导的 DO11.10 细胞中添加可溶形式的 L5 (5 μg/ml)。(E) 抗 CD3 mAb (0.5 μg/ml)、抗 CD28 mAb (0.5 μg/ml) 和 L5 (3 μg/ml) 对 PD-1 转导的 DO11.10 细胞的刺激。(F) PD-L1–Fc (10 μg/ml) 与 hPD-1 stalk-FLAG 结合。抗体浓度为5μg/ml。EH12.2H7 是一种抗-hPD-1 阻断单克隆抗体。数据代表一式三份(C 和 E)或一式两份(D)样本的平均值±SE。a,与对照组相比,P < 0.05(双尾学生 t 检验)。αFLAG,反FLAG;aa, 氨基酸; ITIM,基于免疫受体酪氨酸的抑制基序;ITSM,基于免疫受体酪氨酸的开关基序;TM,跨膜片段;WT,野生型,KO,敲除[2]。
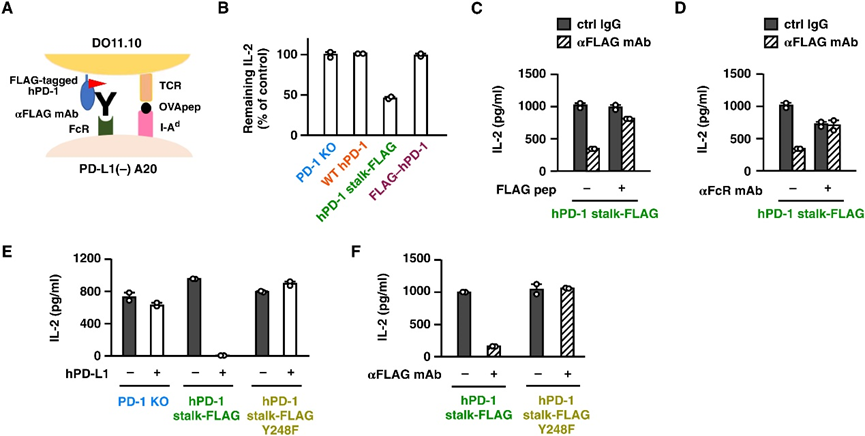
Fig. 2. The utilization of Fc receptor engagement enabled PD-1–mediated immunosuppression by the simple addition of agonist antibody. (A) The experimental system. DO11.10 cells expressing hPD-1 were stimulated with OVA323–339 peptide using PD-L1–deficient A20 B lymphoma as antigen-presenting cells. (B) IL-2 production from PD-1–transduced DO11.10 cells in the presence of anti-FLAG mAb L5 (5 μg/ml). (C and D) The addition of excess FLAG peptide (3 μg/ml) (C) or anti-CD16/32 mAb (10 μg/ml) (D). (E and F) PD-1 stimulation with PD-L1–expressing antigen-presenting cells (E) or L5 (5 μg/ml) using PD-L1–deficient A20 cells (F). The Y248F mutant lacks PD-1 signal transmission. Data represent average ± SE of duplicate samples. FcR, Fc receptor
图 2. Fc 受体结合的利用通过简单添加激动剂抗体实现了 PD-1 介导的免疫抑制。(A) 实验系统。使用 PD-L1 缺陷型 A20 B 淋巴瘤作为抗原呈递细胞,用 OVA323-339 肽刺激表达 hPD-1 的 DO11.10 细胞。(B) 在抗 FLAG mAb L5 (5 μg/ml) 存在的情况下,PD-1 转导的 DO11.10 细胞产生 IL-2。(C 和 D) 添加过量的 FLAG 肽 (3 μg/ml) (C) 或抗 CD16/32 mAb (10 μg/ml) (D)。(E 和 F)使用表达 PD-L1 的抗原呈递细胞 (E) 或使用 PD-L1 缺陷型 A20 细胞 (F) 的 L5 (5 μg/ml) 刺激 PD-1。Y248F 突变体缺乏 PD-1 信号传输。数据代表一式两份样本的平均值±SE。FcR、Fc受体[2]。
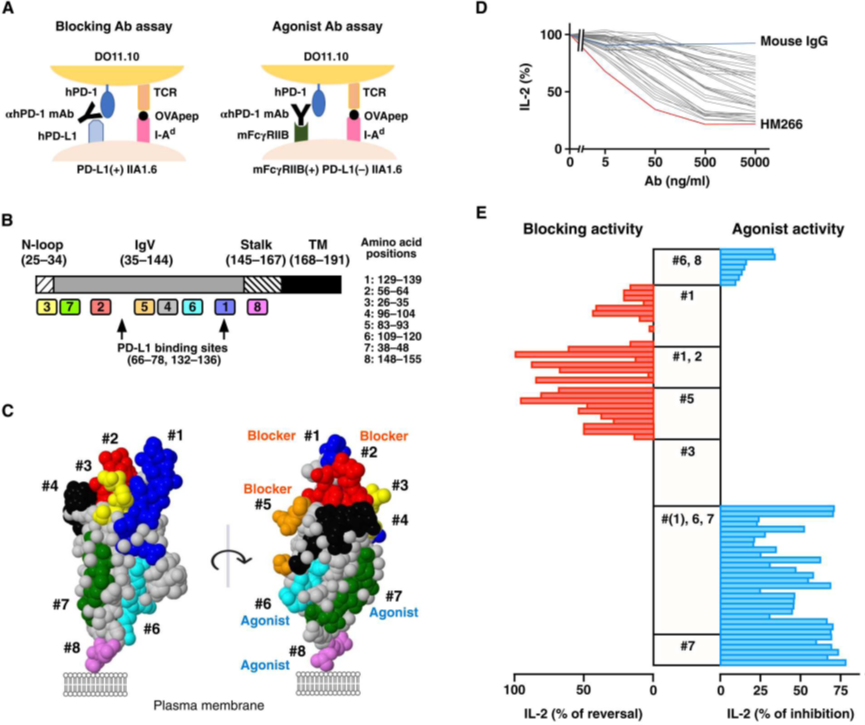
Fig. 3. Binding epitopes of anti–PD-1 agonist mAbs are specifically located in MPER, which is distinct from the region recognized by blocking mAbs. (A) The screening system for blocking and agonistic activities of anti–hPD-1 mAbs. (B) Eight segments thatwere used to classify anti–hPD-1 mAbs by their binding capabilities. (C) The putative locations of the eight segments on the molecular surface of hPD-1. A three-dimensional (3D) model depicts the extracellular part of hPD-1. This 3D model was created using Jmol software based on the structure of hPD-1 from Protein Data Bank (accession code 3RRQ). (D) Activities of anti–hPD-1 agonist mAbs (n = 2). (E) Blocking (red) and agonistic (blue) activities of individual anti–hPD-1 mAb clones (n = 2). Numbers in the center column represent the eight segments in (B). For example, #1 group denotes mAbs that lost binding only when the #1 segment was mutated. Similarly, #(1), 6, 7 indicates that the mutation in #6 and #7 segments critically impaired the binding, and the #1 segment affected the binding to different degrees dependent on mAb clones.
图 3. 抗 PD-1 激动剂 mAb 的结合表位特异性位于 MPER 中,与阻断 mAb 识别的区域不同。(A) 抗 hPD-1 mAb 阻断和激动活性的筛选系统。(B) 用于根据结合能力对抗 hPD-1 mAb 进行分类的八个片段。(C) hPD-1 分子表面八个片段的假定位置。三维 (3D) 模型描绘了 hPD-1 的细胞外部分。此 3D 模型是使用 Jmol 软件根据蛋白质数据库中 hPD-1 的结构创建的(登录号 3RRQ)。(D) 抗 hPD-1 激动剂 mAb 的活性 (n = 2)。(E) 单个抗 hPD-1 mAb 克隆 (n = 2) 的阻断(红色)和激动(蓝色)活性。中心列中的数字代表 (B) 中的八个片段。例如,#1 组表示仅当 #1 片段发生突变时失去结合的 mAb。类似地,#(1)、6、7 表明#6 和#7 片段中的突变严重损害了结合,#1 片段在不同程度上影响结合,这取决于 mAb 克隆[2]。
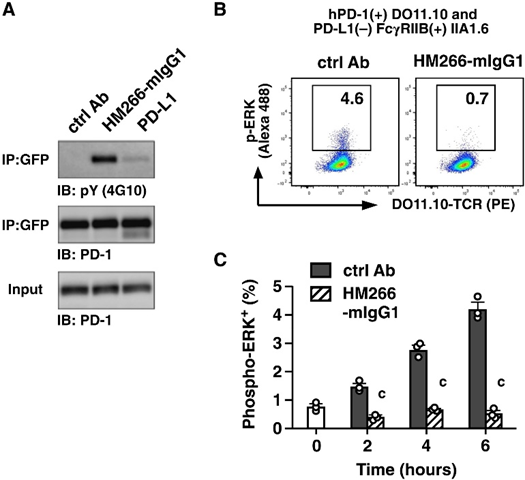
Fig. 4. Anti–PD-1 agonist mAb exerts its immunosuppressive activity by triggeringPD-1 signaling. (A) Western blotting of phosphorylated hPD-1. DO11.10 cells transduced with hPD-1-GFP and SHP-2(C459S) were stimulated with OVA323–339-pulsed A20 cells for 5 min. PD-1 was stimulated with PD-L1–expressing A20 cells or HM266-mIgG1. (B and C) ERK phosphorylation in stimulated DO11.10 cells for the indicated time. Antibody concentration was 5 μg/ml. Data represent average ± SE (n = 3). c, P < 0.001 (two-tailed Student’s t test). IP, immunoprecipitation; PE, phycoerythrin.
图 4. 抗 PD-1 激动剂 mAb 通过触发 PD-1 信号传导发挥其免疫抑制活性。(A) 磷酸化 hPD-1 的蛋白质印迹。用 hPD-1-GFP 和 SHP-2(C459S) 转导的 DO11.10 细胞用 OVA323–339 脉冲 A20 细胞刺激 5 分钟。用表达 PD-L1 的 A20 细胞或 HM266-mIgG1 刺激 PD-1。(B 和 C) 指定时间内受刺激的 DO11.10 细胞中的 ERK 磷酸化。抗体浓度为5μg/ml。数据代表平均值±SE (n = 3)。c,P < 0.001(双尾学生 t 检验)。IP,免疫沉淀;PE,藻红蛋白[2]。
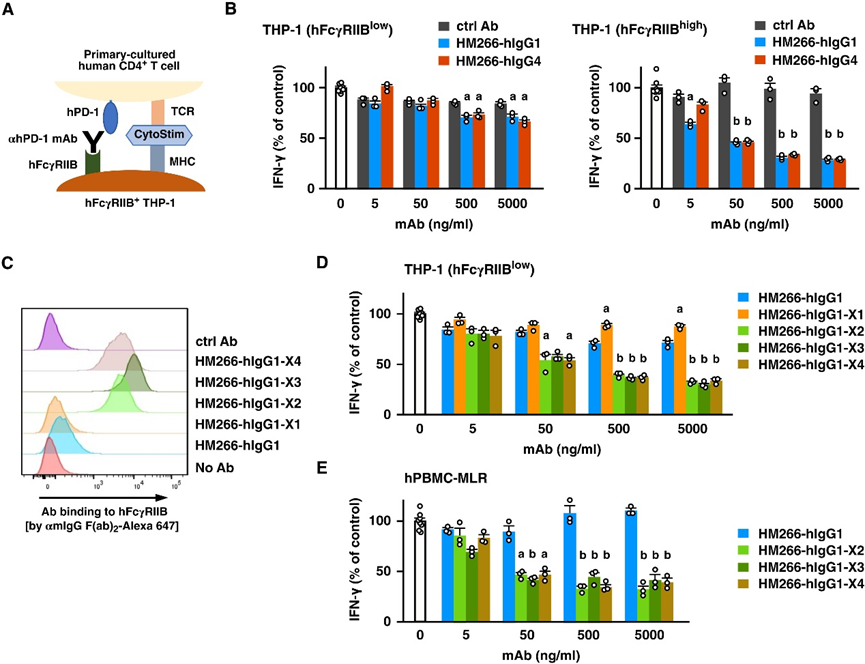
Fig. 5. Anti–PD-1 agonist mAb inhibits primary human T cells. (A) Human primary CD4+ T cells were stimulated with CytoStim in the presence of human FcγRIIBexpressing THP-1 cells. (B) T cells were stimulated using parental (FcγRIIBlow) or FcγRIIB-overexpressing THP-1 cells (FcγRIIBhigh) in the presence of either HM266-hIgG1(K322A) or HM266-hIgG4(S228P). Data represent average ± SE (controls without antibody, n = 8; with antibodies, n = 3). a, P < 0.05; b, P < 0.01; versus control Ab; Tukey-Kramer test. (C) Binding of Fc variants of HM266-hIgG1 to FcγRIIBhigh THP-1 cells. (D and E) The addition of HM266-hIgG1(K322A) and its Fc variants to human CD4+ T cells stimulated with CytoStim (D) or mixed lymphocyte reaction (E). Data represent average ± SE (controls without antibody, n = 8; with antibodies, n = 3). a, P < 0.05; b, P < 0.01; versus HM266-hIgG1; Tukey-Kramer test.
图 5. 抗 PD-1 激动剂 mAb 抑制原代人 T 细胞。(A) 在表达人 FcγRIIB 的 THP-1 细胞存在的情况下,用 CytoStim 刺激人原代 CD4+ T 细胞。(B) 在存在 HM266-hIgG1(K322A) 或 HM266-hIgG4(S228P) 的情况下,使用亲代 (FcγRIIBlow) 或 FcγRIIB 过表达 THP-1 细胞 (FcγRIIBhigh) 刺激 T 细胞。数据代表平均值±SE(无抗体的对照,n = 8;有抗体,n = 3)。a, P < 0.05; b, P < 0.01; 对比对照抗体;Tukey-Kramer 测试。(C) HM266-hIgG1 的 Fc 变体与 FcγRIIBhigh THP-1 细胞的结合。(D 和 E) 将 HM266-hIgG1(K322A) 及其 Fc 变体添加到用 CytoStim (D) 或混合淋巴细胞反应 (E) 刺激的人 CD4+ T 细胞中。数据代表平均值±SE(无抗体的对照,n = 8;有抗体,n = 3)。a, P < 0.05; b, P < 0.01; 与 HM266-hIgG1 相比;Tukey-Kramer 测试[2]。
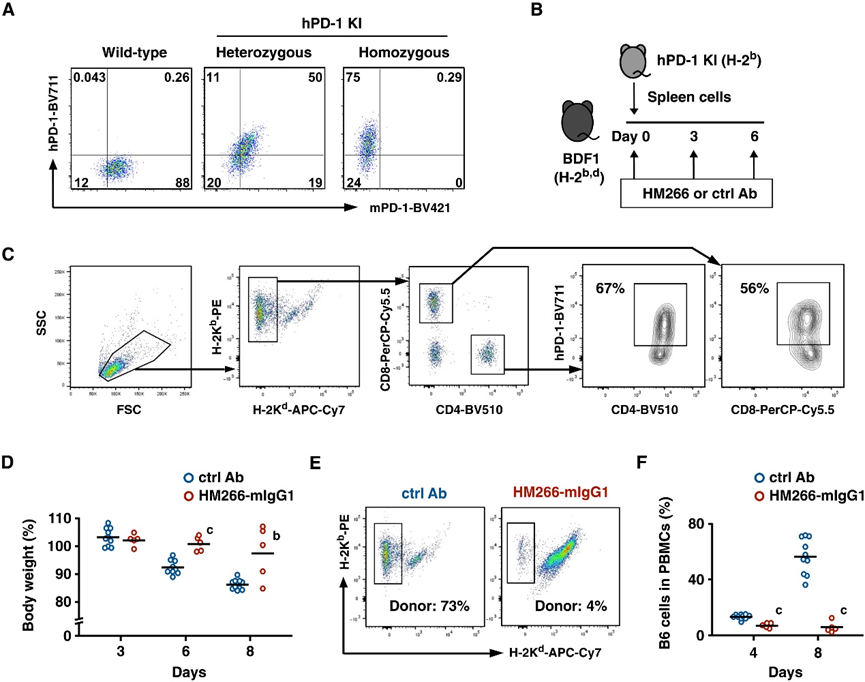
Fig. 6. Anti–PD-1 agonist mAb suppressed GVHD in vivo. (A) PD-1 expression in stimulated T cells from hPD-1 KI mice. (B) Acute GVHD induction in BDF1 mice. (C) hPD-1 expression in donor T cells in PBMCs on day 8. (D) Body weight change. (E and F) Proportions of donor-derived (H-2Kb+ H-2Kd−) cells in PBMCs. Data represent average ± SE (ctrl Ab, n = 10; HM266-mIgG1, n = 5). b, P < 0.01; c, P < 0.001; versus control Ab; two-tailed Student’s t test. SSC, side scatter; FSC, forward scatter.
图 6. 抗 PD-1 激动剂 mAb 在体内抑制 GVHD。(A) 来自 hPD-1 KI 小鼠的受刺激 T 细胞中的 PD-1 表达。(B) BDF1 小鼠的急性 GVHD 诱导。(C) 第 8 天 PBMC 中供体 T 细胞的 hPD-1 表达。(D) 体重变化。(E 和 F) PBMC 中供体来源的 (H-2Kb+ H-2Kd−) 细胞的比例。数据代表平均值±SE(ctrl Ab,n = 10;HM266-mIgG1,n = 5)。b, P < 0.01; c, P < 0.001; 对比对照抗体;双尾学生 t 检验。SSC,侧向散射;FSC,前向散射[2]。
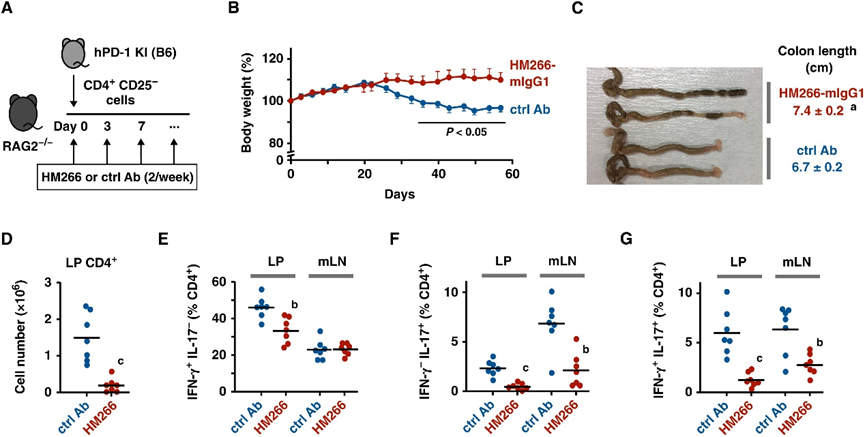
Fig. 7. Anti–PD-1 agonist mAb suppressed the induction of colitis. (A) Colitis induction by the transfer of CD4+ CD25− T cells from hPD-1 KI mice. HM266-mIgG1 (0.5 mg per mouse) was given twice a week. (B) Body weight change after cell transfer. (C) Macroscopic picture of the colon and cecum on day 58. (D) CD4+ T cell numbers in the lamina propria (LP). (E to G) CD4+ T cells producing IFN-γ (E), IL-17 (F), or both (G) in the lamina propria and mesenteric lymph nodes (mLN) on day 58. Data represent average ± SE of seven mice. a, P < 0.05; b, P < 0.01; c, P < 0.001; versus control Ab; two-tailed Student’s t test.
图 7. 抗 PD-1 激动剂 mAb 抑制结肠炎的诱发。(A) 通过从 hPD-1 KI 小鼠转移 CD4+ CD25- T 细胞诱导结肠炎。HM266-mIgG1(每只小鼠 0.5 毫克)每周给药两次。(B) 细胞转移后的体重变化。(C) 第 58 天结肠和盲肠的宏观图片。(D) 固有层 (LP) 中的 CD4+ T 细胞数量。(E 到 G)CD4+ T 细胞在第 58 天在固有层和肠系膜淋巴结 (mLN) 中产生 IFN-γ (E)、IL-17 (F) 或两者 (G)。数据代表七个的平均值±标准误差 老鼠。a, P < 0.05; b, P < 0.01; c, P < 0.001; 对比对照抗体;双尾学生 t 检验[2]。
本文仅作信息分享,不代表礼进生物公司立场和观点,也不作治疗方案推荐和介绍。如有需求,请咨询和联系正规医疗机构。
参考文献:
1.Agonistic anti-PD-1 antibodies turn on the immunosuppressive activity of PD-1, JANUARY 25, 2023, https://acir.org/weekly-digests/2023/january/agonistic-anti-pd-1-antibodies-turn-on-the-immunosuppressive-activity-of-pd-1
2. Suzuki K, Tajima M, Tokumaru Y, Oshiro Y, Nagata S, Kamada H, Kihara M, Nakano K, Honjo T, Ohta A. Anti-PD-1 antibodies recognizing the membrane-proximal region are PD-1 agonists that can down-regulate inflammatory diseases. Sci Immunol. 2023 Jan 13.









 沪公网安备 31011502015333号
沪公网安备 31011502015333号