

学习资源
科普文章
礼进生物4-1BB激动剂临床又传捷报:肿瘤免疫远不止于PD-1
- 持续观察到的患者受益是最有效的鼓励和回馈, 让我们在新的一年继续努力,促成LVGN6051的早日上市。
LVGN6051是礼进生物自研开发的一款靶向肿瘤的4-1BB 条件性激动抗体,严格依赖 FcγRIIB来激活NK细胞和肿瘤抗原活化后的CD8+ T细胞,针对性地提高其抗肿瘤细胞毒性。LVGN6051联合PD-1单抗Keytruda(帕博利珠单抗 Pembrolizumab)的Ib期正在美国进行,旨在评估LVGN6051联合Pembrolizumab治疗实体瘤的疗效和安全性。结果显示,LVGN6051单药及与Pembrolizumab联合具有良好的安全性及耐受性,并且与Pembrolizumab联用方案在多个适应症中均显示了初步的抗肿瘤活性,如图1所示其在PD-1, CTLA4和PD-L1均耐药的晚期黑色素瘤的显著疗效。
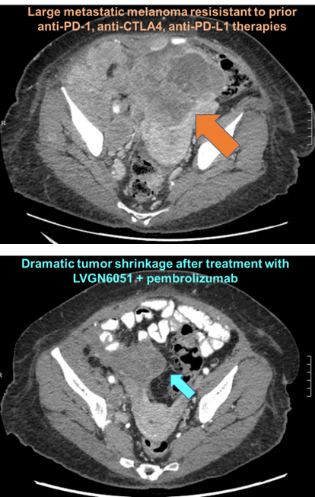
图1 LVGN6051与Pembrolizumab联用对PD-1/CTLA4/PD-L1耐药的晚期实体瘤的有效性。
上图:先前PD-1, CTLA4和PD-L1治疗均产生耐药的晚期黑色素瘤患者用药前病灶;
下图:接受LVGN6051与Pembrolizumab联合治疗后观察到的明显肿瘤缩小。
肿瘤免疫机制
2013年,Chen和Mellman[1] 提出“肿瘤-免疫循环”的概念,即抗肿瘤免疫反应有效杀伤肿瘤细胞,需要经历数个步骤:①肿瘤形成后生成新抗原,释放入机体后被树突状细胞(dendritic cell, DC)捕获;②DC将捕获的抗原递呈至T细胞;③效应T细胞激活,产生对抗癌症抗原的特异性免疫反应(在这一阶段确定免疫反应的性质,效应T细胞和调节T细胞的比例是最终结局的重要预测因素);④活化的效应T细胞迁移至肿瘤床;⑤活化的效应T细胞在肿瘤床浸润;⑥效应T细胞特异性识别并与肿瘤细胞结合(通过同源抗体与组织相容性复合物I结合);⑦目标肿瘤细胞被杀灭;⑧被杀灭的肿瘤细胞进一步释放更多肿瘤相关抗体(即回到步骤①)。通过这一循环使免疫反应范围增大,强度增强。但在恶性肿瘤患者中,DC和T细胞可能将肿瘤抗原视为自体成分而不被识别,T细胞无法在肿瘤组织中浸润,或肿瘤微环境中的一些因素抑制效应T细胞的功能,这些因素均会导致肿瘤-免疫肿瘤循环应答无法达到最佳效果。
免疫肿瘤(immuno-oncology, I-O)治疗的目标是启动或重启患者的癌症-肿瘤循环,放大免疫效应,但不造成无限制的自身免疫应答[2]。
PD-1是表达于细胞毒T细胞表面的免疫检查点受体,其配体包括PD-L1和PD-L2。临床前研究显示,阻断PD-1可使被耗竭的T细胞复苏,并恢复其细胞毒性功能[3]。4-1BB同样是表达于细胞毒T细胞表面的免疫检查点受体,其配体为4-1BBL。4-1BB与抑制性检查点PD-1相比的明显区别在于,4-1BB(又称为CD137)是共刺激靶点,激活4-1BB下游信号通路可直接增强T细胞的细胞毒性功能。临床前研究表明,4-1BB和PD-1联用有明显的协调作用,极具增强PD-1单药疗效或克服耐药的潜力[4],详见《PD-1抗体联合4-1BB激动剂的新辅助疗法》
LVGN6051
TNFRSF信号通路刺激多种免疫细胞的激活和增殖,包括髓系细胞和T细胞,为癌症免疫治疗的开发提供了潜在靶点。然而,TNFRSF激动性抗体在临床中成功的案例很少,可能是由于早期研发对于TNFRSF下游信号通路依赖受体多聚体的机制不清晰,或者由于剂量限制毒性,临床开发受限于过低的剂量。激活性抗体的激动活性可受到Fab、铰链或Fc区域的影响。通过多年临床前及临床研究积累,Fc-Fc𝛾RIIB相互作用已被确定为激动活性(疗效和毒性)的主要决定因素。FcγRIIB可通过抗体介导TNFRSF受体聚集,激活其下游信号通路,发挥体内抗肿瘤活性的重要作用。体外研究表明,无Fc交联依赖性的强激动性抗体在与靶标结合时表现出激动性,在有FcγRs的情况下成为超级激动剂,导致临床很难克服的毒性问题。相反,在没有Fc交联的情况下,另一类抗TNFRSF抗体可能呈现很弱或无检测到的激动活性,却可在Fc-FcγRIIB交联时表现出强激动活性,这类Fc-FcγRIIB介导的条件性激动剂更有临床开发空间(引自 《TNFRSF激动剂抗体:FcγRIIB交联的作用》) [5]。
与FcγRIIB选择性结合,且FcγRIIB交联依赖性激活TNFRSF的抗体Fc端工程化改造是礼进生物的核心技术之一}。 LVGN6051就是礼进生物通过xLinkAb激动性抗体开发平台自研的4-1BB激动性单抗。 礼进生物Fc工程化改造技术普适于TNFRSF大部分成员,包括CD40、CD137、OX40、GITR和CD27等。 例如,礼进生物针对CD40靶点的另一款激动性抗体LVGN7409同样表现出优异临床初期有效及安全性。此外,交联依赖性还可用于开发抗TNFRSF的双特异性或多特异性抗体,其中FcγRIIB可被肿瘤抗原或免疫靶点替代。与这些肿瘤选择性靶点的结合可导致多价肿瘤靶向-抗体-TNFRSF复合物的形成,进而在肿瘤微环境中促进TNFRSF的聚集和下游信号选择性激活(图2). [5], 详见《FcγRIIB交联依赖性激动性抗体LVGN6051(抗CD137)和LVGN7409(抗CD40)的开发机制》
综上所述,免疫共刺激靶点,特别是TNFRSF成员如CD137和CD40,使得肿瘤免疫疗法仍存在巨大发展空间。从临床疗效、安全性、生产工艺和分子稳定性等方面考虑,IgG结构的单克隆激动性抗体相比于早研阶段的双抗有其独特的优势。包括礼进生物公司开发的xLinkAb模型在内,进一步探索FcγRIIB交联依赖的抗体Fc工程改造方法仍具有巨大的发展空间。
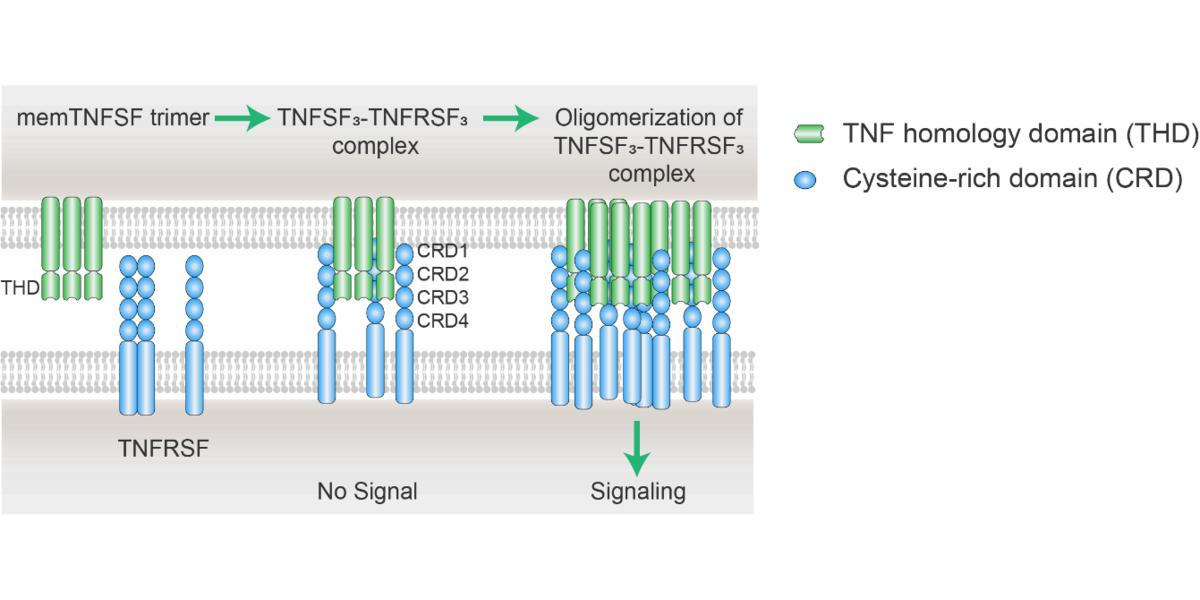
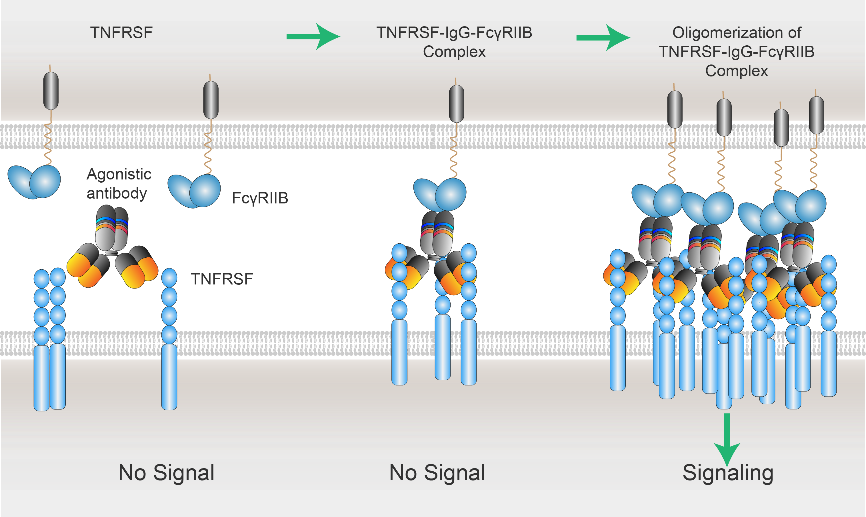
图2 礼进生物xLinkAb激动性抗体作用机制
上图:生理性TNFRSF受体激活是通过细胞表面TNFSF配体和受体相结合时诱导的,受体-配体三聚体的交联和寡聚是受体下游信号激活的前提条件;
下图:xLinkAb单抗Fab端特异性结合TNFRSF靶点,同时其Fc端选择性结合FcγRIIB,其介导促成TNFSFR-IgG-FcγRIIB复合物的集聚,从而激活TNFRSF下游信号通路,释放其生物学功能。
礼进生物
礼进生物是一家创新的生物科技制药公司,专注于开发创新的肿瘤免疫疗法。利用其自主研发的xLinkAb技术平台,平衡候选抗体的多种功能,产生具有肿瘤靶向免疫激活功能的激动性抗体,包括临床候选药物LVGN7409 (CD40激动性单抗)和LVGN6051 (4-1BB激动性单抗)。LVGN7409在中国和美国I期临床试验顺利推进,已获得初步安全及有效性数据。LVGN6051的临床安全性和活性已得到初步证实,与帕博利珠单抗注射液联用治疗成人晚期肿瘤的Ib /II期临床试验正在美国开展。同时,LVGN6051联合血管内皮生长因子受体小分子抑制剂的II期临床试验正在中国进行。伴随临床推进,持续观察到LVGN6051和LVGN7409在临床上帮助癌症病人受益,是礼进生物员工致力于做创新药的动力和欣慰。我们将在新的一年继续努力,促成全球创新自研的抗体药物早日上市。
本文仅作信息分享,不代表礼进生物公司立场和观点,也不作治疗方案推荐和介绍。如有需求,请咨询和联系正规医疗机构。
参考文献
1. Chen, D.S. and I. Mellman, Oncology meets immunology: thecancer-immunity cycle. Immunity, 2013. 39(1):p. 1-10.
2. Zhang, S. and S.Ren, [Novel Immuno-oncology Therapy:Current Status of Clinical Research and Prospect of Application]. ZhongguoFei Ai Za Zhi, 2017. 20(9): p.645-651.
3. Chen, L. and X.Han, Anti-PD-1/PD-L1 therapy of humancancer: past, present, and future. J Clin Invest, 2015. 125(9): p. 3384-91.
4. Liu, J., et al.,Improved Efficacy of Neoadjuvant Comparedto Adjuvant Immunotherapy to Eradicate Metastatic Disease. CancerDiscovery, 2016. 6(12): p.1382-1399.
5. Liu, L., et al.,Antibody-Targeted TNFRSF Activation forCancer Immunotherapy: The Role of FcγRIIB Cross-Linking. Frontiers in Pharmacology,2022. 13.
礼进生物(Lyvgen Biopharma)的网站(中文)
礼进生物创建于2016年,以其全球创新的肿瘤免疫激动性抗体管线为核心,凭借其世界级的研发团队,最前沿的药物研发项目,以及开放式创新的策略, 有望引领国内新药研发行业走向全球。
https://user-assets.sxlcdn.com/images/676507/FiTA8WK-FQRyXrQDyd-HDkY3tpfI.png?imageMogr2/strip/auto-orient/thumbnail/1200x630>/format/png




 沪公网安备 31011502015333号
沪公网安备 31011502015333号